
Struktura fluorku wapnia (CaF2), właściwości, zastosowanie
Plik fluorek wapnia Jest to nieorganiczna substancja stała utworzona przez jeden atom wapnia (Ca) i dwa atomy fluoru (F). Jego wzór chemiczny to CaFdwa i jest to krystaliczna szaro-biała substancja stała.
W naturze występuje w mineralnym fluorycie lub fluorycie. Występuje naturalnie w kościach i zębach. Mineralny fluoryt jest głównym źródłem pozyskiwania innych związków fluoru.

Ponadto CaFdwa Służy do zapobiegania próchnicy zębów, dlatego jest dodawany do materiałów używanych przez dentystów do ich leczenia. W rzeczywistości fluorek wapnia jest również dodawany do wody pitnej (wody, którą można pić), aby ludność czerpała korzyści z jego spożycia i mycia zębów..
CaFdwa Jest stosowany w postaci dużych kryształów w sprzęcie optycznym i aparatach. Jest również stosowany w małych urządzeniach, które służą do wykrywania, jak bardzo dana osoba była narażona na promieniowanie.
Indeks artykułów
- 1 Struktura
- 2 Nazewnictwo
- 3 Właściwości
- 3.1 Stan fizyczny
- 3.2 Masa cząsteczkowa
- 3.3 Temperatura topnienia
- 3.4 Temperatura wrzenia
- 3.5 Gęstość
- 3.6 Współczynnik załamania światła
- 3.7 Rozpuszczalność
- 3.8 Właściwości chemiczne
- 4 Obecność w przyrodzie
- 5 zastosowań
- 5.1 - W otrzymywaniu związków fluoru
- 5.2 - W pielęgnacji zębów
- 5.3 - W soczewkach do sprzętu optycznego
- 5.4 - W przemyśle metalurgicznym
- 5.5 - W detektorach radioaktywności lub niebezpiecznego promieniowania
- 5.6 - Inne zastosowania
- 6 Odnośniki
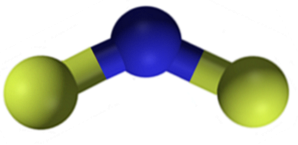
Struktura
Fluorek wapnia CaFdwa jest związkiem jonowym utworzonym przez kation wapnia Cadwa+ i dwa aniony fluorkowe F-. Jednak niektóre źródła informacji wskazują, że ich powiązania mają pewien charakter kowalencyjny.
Nomenklatura
Fluorek wapnia
Nieruchomości
Stan fizyczny
Bezbarwne do szarawobiałego ciała stałego o sześciennej strukturze kryształu.
Waga molekularna
78,07 g / mol
Temperatura topnienia
1418 ºC
Temperatura wrzenia
2533 ºC
Gęstość
3,18 g / cm3 w 20 ° C.
Współczynnik załamania światła
1.4328
Rozpuszczalność
Jest nierozpuszczalny w wodzie w temperaturze 20 ° C. Prawie nierozpuszczalny w 25 ° C: 0,002 g / 100 ml wody. Słabo rozpuszczalny w kwasach.
Właściwości chemiczne
Jego właściwości utleniające lub redukujące są bardzo słabe, jednak mogą wystąpić te reakcje. Chociaż ogólnie w bardzo niewielu przypadkach.
Jest obojętny na organiczne substancje chemiczne i wiele kwasów, w tym kwas fluorowodorowy HF. Rozpuszcza się powoli w kwasie azotowym HNO3.
Nie jest łatwopalny. Nie reaguje szybko z powietrzem ani wodą.
Ze względu na niskie powinowactwo do wody, nawet jeśli jest narażona na wysoki procent wilgoci, nie ma na nią wpływu nawet przez miesiąc w normalnej temperaturze pokojowej..
W obecności wilgoci ściany jego kryształów rozpuszczają się powoli w temperaturach powyżej 600 ° C. W suchym środowisku można go używać w temperaturze do około 1000 ° C bez znaczącego wpływu.
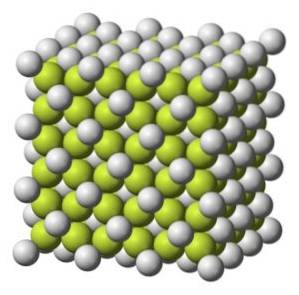
Obecność w przyrodzie
Fluorek wapnia CaFdwa występujący naturalnie w mineralnym fluorycie lub fluorycie.
Chociaż plik CaFdwa czysty jest bezbarwny mineralny fluoryt, często jest zabarwiony obecnością elektronów uwięzionych w "dziurach" struktury krystalicznej.
Minerał ten jest wysoko ceniony ze względu na szklisty połysk i różnorodność kolorów (fioletowy, niebieski, zielony, żółty, bezbarwny, brązowy, różowy, czarny i czerwonawo-pomarańczowy). Mówi się, że jest to „najbardziej kolorowy minerał na świecie”.





Fluorek wapnia znajduje się również w kościach w ilości od 0,2 do 0,65%, a także w szkliwie zębów w 0,33-0,59%.
Aplikacje
- W otrzymywaniu związków fluoru
Mineralny fluoryt CaFdwa Jest podstawowym lub większościowym źródłem fluoru na całym świecie. Jest surowcem do przygotowania prawie wszystkich związków fluoru.
Najważniejszym z nich jest kwas fluorowodorowy HF, z którego otrzymywane są pozostałe związki fluorowe. Jon fluorkowy F.- uwolniony z minerału w reakcji ze stężonym kwasem siarkowym H.dwapołudniowy zachód4:
CaFdwa (świeci) + H.dwapołudniowy zachód4 (ciecz) → CaSO4 (ciało stałe) + 2 HF (gaz)
- W pielęgnacji zębów
Fluorek wapnia CaFdwa jest środkiem do zapobiegania próchnicy. Służy do fluoryzacji wody pitnej (wody, którą można pić).
Ponadto niskie stężenia fluoru F- (rzędu 0,1 części na milion) stosowany w pastach do zębów i płynach do płukania ust ma bardzo pozytywny wpływ na profilaktykę stomatologiczną ubytków próchnicowych.

Nanocząsteczki CaFdwa bardziej efektywny
Chociaż fluorki są używane w pastach do zębów i płukankach, niskie stężenie wapnia (Ca) w ślinie powoduje, że nie tworzą się złogi CaF.dwa na zębach tak skutecznie, jak to możliwe.
Dlatego wymyślono sposób na otrzymywanie proszku CaF.dwa w postaci nanocząstek.
W tym celu używana jest suszarka rozpyłowa (z angielskiego suszarka rozpyłowa) gdzie dwa roztwory (jeden z wodorotlenku wapnia Ca (OH)dwa i jeden z fluorku amonu NH4F) są mieszane podczas rozpylania w komorze strumieniem gorącego powietrza.
Następnie zachodzi następująca reakcja:
Ca (OH)dwa + NH4F → CaFdwa (ciało stałe) + NH4O
NH4OH ulatnia się jako NH3 i HdwaAlbo i nanocząstki CaF pozostajądwa.
Mają wysoką reaktywność i większą rozpuszczalność, dzięki czemu są bardziej skuteczne w remineralizacji zębów i przeciwpróchniczo.
- W soczewkach do sprzętu optycznego
Fluorek wapnia służy do budowy elementów optycznych, takich jak pryzmaty i okienka spektrofotometrów światła podczerwonego i ultrafioletowego (UV)..
Urządzenia te pozwalają nam mierzyć ilość światła pochłanianego przez materiał, gdy przez niego przechodzi.
CaFdwa jest przezroczysty w tych obszarach widma światła, ma wyjątkowo niski współczynnik załamania światła i zapewnia bardziej wydajną rozdzielczość niż NaCl w zakresie 1500-4000 cm.-1.
Dzięki swojej stabilności chemicznej wytrzymuje niekorzystne warunki, dlatego elementy optyczne z CaFdwa nie są atakowani. Ma również wysoką twardość.
W aparatach
Niektórzy producenci aparatów używają obiektywów CaFdwa sztucznie skrystalizowany w celu zmniejszenia rozpraszania światła i uzyskania doskonałej korekcji zniekształceń kolorów.

- W przemyśle metalurgicznym
CaFdwa Jest stosowany jako topnik w przemyśle metalurgicznym, ponieważ jest źródłem wapnia nierozpuszczalnego w wodzie, a zatem jest skuteczny w zastosowaniach wrażliwych na tlen..
Służy do topienia i obróbki żelaza i stali w postaci płynnej. Wynika to z faktu, że ma on temperaturę topnienia podobną do żelaza, a także może rozpuszczać tlenki i metale..
- W detektorach radioaktywności lub niebezpiecznego promieniowania
CaFdwa jest to materiał termoluminescencyjny. Oznacza to, że może absorbować promieniowanie w elektronach swojej struktury krystalicznej, a później, po podgrzaniu, uwalniać je w postaci światła..
To emitowane światło można zmierzyć za pomocą sygnału elektrycznego. Sygnał ten jest proporcjonalny do ilości promieniowania otrzymanego przez materiał. Oznacza to, że im większa ilość otrzymanego promieniowania, tym większa ilość światła, które wyemituje po podgrzaniu..
Z tego powodu CaFdwa Znajduje zastosowanie w tak zwanych dozymetrach osobistych, z których korzystają osoby narażone na niebezpieczne promieniowanie i chcące wiedzieć, ile promieniowania otrzymały w danym okresie.
- Inne zastosowania
- Jest stosowany jako katalizator w reakcjach chemicznych odwadniania i odwodornienia w syntezie związków organicznych.
- Stosowany jest w alkalicznych elektrodach spawalniczych. Uzyskuje się mocniejszą spoinę niż w przypadku elektrod kwasowych. Elektrody te są przydatne w produkcji statków i zbiorników ze stali wysokociśnieniowej..
- Jako suplement diety w bardzo małych ilościach (ppm lub części na milion).

Bibliografia
- Pirmoradian, M. i Hooshmand, T. (2019). Remineralizacja i właściwości antybakteryjne nanokompozytów dentystycznych na bazie żywic. Synteza i charakterystyka fluorku wapnia (CaFdwa). W zastosowaniach materiałów nanokompozytowych w stomatologii. Odzyskany z sciencedirect.com.
- NAS. National Library of Medicine. (2019). Fluorek wapnia. Odzyskany z pubchem.ncbi.nlm.nih.gov.
- Weman, K. (2012). Ręczne spawanie łukowe (MMA) elektrodami otulonymi. W Podręczniku procesów spawalniczych (wydanie drugie). Odzyskany z sciencedirect.com.
- Hanning, M. i Hanning, C. (2013). Nanobiomateriały w stomatologii zachowawczej. Fluorek wapnia w postaci nanometrycznej. W Nanobiomaterials in Clinical Dentistry. Odzyskany z sciencedirect.com.
- Ropp, R.C. (2013). Grupa 17 (H, F, Cl, Br, I) związki ziem alkalicznych. Fluorek wapnia. W Encyclopedia of the Alkaline Earth Compounds. Odzyskany z sciencedirect.com.
- Cotton, F. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Valkovic, V. (2000). Pomiary radioaktywności. W radioaktywności w środowisku. Detektory termoluminescencyjne (TLD). Odzyskany z sciencedirect.com.


Jeszcze bez komentarzy