
Struktura, właściwości i zastosowanie fluorku potasu (KF)
Plik fluorek potasu Jest to nieorganiczny halogenek, który składa się z soli utworzonej między metalem a halogenem. Jego wzór chemiczny to KF, co oznacza, że dla każdego kationu K.+ jest F- odpowiednik. Jak widać, oddziaływania są elektrostatyczne, w wyniku czego nie występują kowalencyjne wiązania K-F..
Sól ta charakteryzuje się wyjątkową rozpuszczalnością w wodzie, dzięki czemu tworzy hydraty, wchłania wilgoć i rozpływa się. Dlatego bardzo łatwo jest przygotować jego wodne roztwory, które służą jako źródło anionów fluorkowych do wszystkich syntez, w których chcesz go włączyć do jakiejś struktury..
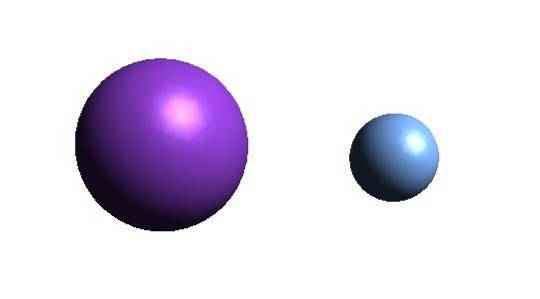
Powyżej znajduje się kation K.+ (fioletowa kula) i anion F- (niebieskawa kula). Oba jony oddziałują ze sobą przyciągając się swoimi ładunkami +1 i -1.
Chociaż KF nie jest tak niebezpieczny jak HF, fakt, że ma anion F.-, czyni ją toksyczną solą. Dlatego ich roztwory znalazły zastosowanie jako insektycydy.
KI jest wytwarzany w reakcji węglanu potasu z kwasem fluorowodorowym, w wyniku czego powstaje wodorofluorek potasu (KHFdwa); który w wyniku rozkładu termicznego kończy się powstaniem fluorku potasu.
Indeks artykułów
- 1 Struktura fluorku potasu
- 1.1 Nawilża
- 2 Właściwości
- 2.1 Masa cząsteczkowa
- 2.2 Wygląd fizyczny (kolor)
- 2.3 Smak
- 2.4 Temperatura wrzenia
- 2.5 Temperatura topnienia
- 2.6 Rozpuszczalność
- 2.7 Rozpuszczalność w wodzie
- 2.8 Gęstość
- 2.9 Prężność par
- 2.10 Rozkład
- 2.11 Działanie korozyjne
- 2.12 Temperatura zapłonu
- 2.13 Eksperymentalny współczynnik załamania światła (ηD)
- 2.14 Stabilność
- 3 Zastosowania
- 3.1 Dostosuj pH
- 3.2 Źródło fluoru
- 3.3 Synteza fluorowęglowodorów
- 3.4 Fluoryzacja
- 3.5 Różne
- 4 Odnośniki
Struktura fluorku potasu
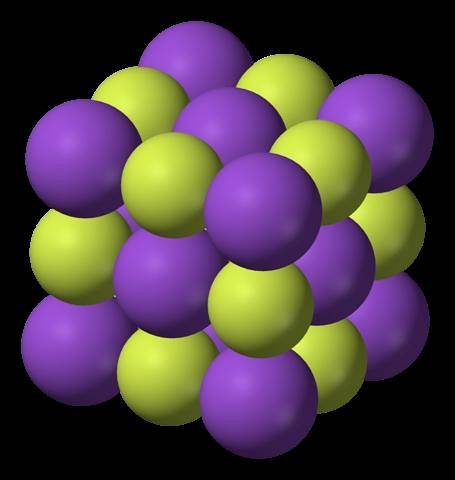
Górny obraz przedstawia strukturę fluorku potasu. Fioletowe kule, jak na pierwszym obrazie, reprezentują kationy K.+; podczas gdy żółtawe kule reprezentują aniony F-.
Zauważ, że układ jest sześcienny i odpowiada strukturze podobnej do soli kamiennej, bardzo podobnej do struktury chlorku sodu. Wszystkie kule są otoczone sześcioma sąsiadami, które tworzą ośmiościan KF6 lub FK6; to znaczy, każdy K+ otacza się sześcioma F.-, i to samo dzieje się na odwrót.
Wspomniano wcześniej, że KF jest higroskopijny i dlatego pochłania wilgoć z otoczenia. W takim przypadku przedstawiony układ odpowiadałby postaci bezwodnej (bez wody), a nie jej hydratom; które pochłaniają tak dużo wody, że nawet rozpuszczają się i „topią” (rozpływają się).
Nawilża
Struktury krystaliczne hydratów stają się mniej proste. Dlaczego? Ponieważ teraz cząsteczki wody wpływają bezpośrednio na aranżacje i oddziałują z jonami K.+ i F.-. Jednym z najbardziej stabilnych hydratów jest KF2HdwaO i KF 4HdwaLUB.
W obu hydratach wspomniane ośmiościany są zdeformowane przez cząsteczki wody. Wynika to głównie z wiązań wodorowych między F.- i H.dwaO (F.--HOH). Badania krystalograficzne wykazały, że pomimo tego oba jony nadal mają tę samą liczbę sąsiadów.
W wyniku tego pierwotna sześcienna struktura bezwodnego fluorku potasu staje się układem jednoskośnym, a nawet romboedrycznym..
Te bezwodne mają wspólną właściwość rozpływania się, więc ich białe kryształy, pozostawione w kontakcie z zimną mgłą, w krótkim czasie stałyby się wodniste..
Nieruchomości
Waga molekularna
58,097 g / mol.
Wygląd fizyczny (kolor)
Białe sześcienne kryształy lub rozpływający się biały krystaliczny proszek.
Smak
Ostry słony smak.
Temperatura wrzenia
Od 2,741 ° F do 760 mmHg (1502 ° C). W stanie ciekłym staje się przewodnikiem prądu elektrycznego, chociaż aniony F- nie współpracują w takim samym stopniu jak K+.
Temperatura topnienia
1,576 ° F; 858 ° C; 1131 K (bezwodny KF). Wskazuje to na jego silne wiązania jonowe..
Rozpuszczalność
Rozpuszczalny w HF, ale nierozpuszczalny w alkoholu. To pokazuje, że wiązania wodorowe między fluorem i alkoholami, F--HOR, nie sprzyjają procesowi solwatacji przeciwko rozpuszczaniu jego sieci krystalicznej.
Rozpuszczalność w wodzie
Bezwodny 92 g / 100 ml (18 ° C); 102 g / 100 ml (25 ° C); dwuwodzian 349,3 g / 100 ml (18 ° C). Oznacza to, że gdy KF jest uwodniony, staje się bardziej rozpuszczalny w wodzie..
Gęstość
2,48 g / cm3.
Ciśnienie pary
100 kPa (750 mmHg) przy 1499 ° C.
Rozkład
Po podgrzaniu do rozkładu wydziela toksyczny dym tlenku potasu i fluorowodoru..
Działanie żrące
Wodny roztwór powoduje korozję szkła i porcelany.
Temperatura zapłonu
Nie jest substancją łatwopalną
Eksperymentalny współczynnik załamania światła (ηD)
1,363.
Stabilność
Stabilny, jeśli jest chroniony przed wilgocią, w przeciwnym razie ciało stałe rozpuści się. Niekompatybilny z mocnymi kwasami i zasadami.
Aplikacje
Dostosuj pH
Wodne roztwory fluorku potasu są używane w zastosowaniach i procesach przemysłowych; Na przykład roztwory Karla Fischera pozwalają na regulację pH w produkcji w zakładach przetwórstwa tekstyliów i pralniach (przybliżają je do wartości 7).
Źródło fluoru
Fluorek potasu jest po fluorowodorze głównym źródłem pozyskiwania fluoru. Pierwiastek ten jest używany w elektrowniach jądrowych oraz do produkcji związków nieorganicznych i organicznych, niektóre z zastosowaniami, takimi jak wprowadzanie go do past do zębów..
Synteza fluorowęglowodorów
Fluorek potasu można stosować w syntezie fluorowęglowodoru lub fluorowęglowodoru z chlorowęglowodoru, stosując reakcję Finkeisteiny. W tej reakcji jako rozpuszczalniki stosuje się glikol etylenowy i dimetylosulfotlenek..
Fluoryzacja
Ponieważ jest źródłem fluoru, gdy jest rozpuszczony w wodzie, z jego roztworów można syntetyzować złożone fluorki; to znaczy, że dodaje się do nich F.- do konstrukcji. Przykładem jest następujące równanie chemiczne:
MnBrdwa(ac) + 3KF (ac) => KMnF3(s) + 2 KB (ac)
Następnie wytrąca się mieszany fluorek KMnF3. Tak więc F.- tak, że jest częścią złożonej soli metalu. Oprócz manganu mogą wytrącać się fluorki innych metali: KCoF3, KFeF3, KNiF3, KCuF3 i KZnF3.
Podobnie, fluor można kowalencyjnie wprowadzić do pierścienia aromatycznego, syntetyzując organofluorki.
Różnorodny
KF jest używany jako półprodukt lub surowiec do syntezy związków, które są używane głównie w agrochemikaliach lub produktach pestycydowych..
Ponadto jest stosowany jako topnik do spoin i do wytrawiania szkła; to znaczy, że jego wodny roztwór zjada powierzchnię szkła i na formie drukuje żądane wykończenie.
Bibliografia
- Książka chemiczna. (2017). Fluorek potasu. Odzyskane z: chemicalbook.com
- PubChem. (2019). Fluorek potasu. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- T. H. Anderson i E. C. Lincafelte. (1951). Struktura dwuwodzianu fluorku potasu. Acta Cryst. 4, 181.
- Królewskie Towarzystwo Chemii. (2015). Fluorek potasu. ChemSpider. Źródło: chemspider.com
- Maquimex. (s.f.). Fluorek potasu. Odzyskany z: maquimex.com



Jeszcze bez komentarzy