
Struktura fosforanu sodu, właściwości, synteza, zastosowania

Plik Fosforan sodu jest nieorganiczną solą, której wzór chemiczny to Na3PO4. Jest również nazywany fosforanem trójsodowym (TSP): Fosforan trisodowy), czyli trójzasadowy fosforan sodu, ponieważ całkowicie brakuje mu możliwości oddawania jonów wodorowych H.+.
Kiedy jest określany w liczbie mnogiej, fosforany sodu, odnosi się do całego kompendium soli, uwodnionych lub nie, pochodzących z oddziaływań elektrostatycznych między Na+ i PO43-. Niektóre z tych soli składają się nawet z pirofosforanów sodu lub nieorganicznych polimerów zawierających PO43- jako monomer.

Dlatego, o ile nie zostanie podana specyfikacja, zawsze będzie odnosić się do Na3PO4, a nie NaHdwaPO4, NadwaHPO4, Na4P.dwaLUB7 ani żadnej innej soli.
Powyższe zdjęcie pokazuje wygląd fosforanu sodu, który ma białe kryształy podobne do zwykłej lub stołowej soli, lub jest kupowany jako biały, bezpostaciowy proszek. Następnie3PO4 jest zdolny do tworzenia różnych hydratów, będąc Na3PO412HdwaAlbo ten, który jest najczęściej sprzedawany.
Znajduje zastosowanie głównie w przemyśle spożywczym, w detergentach, suplementach sportowych, służy jako hiperosmotyczny środek przeczyszczający.
Indeks artykułów
- 1 Struktura chemiczna
- 2 Właściwości
- 2.1 Wygląd fizyczny
- 2.2 Temperatura topnienia
- 2.3 Temperatura wrzenia
- 2.4 Rozpuszczalność w wodzie
- 2.5 Gęstość
- 2.6 Stabilność
- 2,7 pH
- 3 Synteza
- 4 Zastosowania
- 4.1 Jedzenie
- 4.2 Detergenty
- 4.3 Leczniczy
- 5 Referencje
Struktura chemiczna
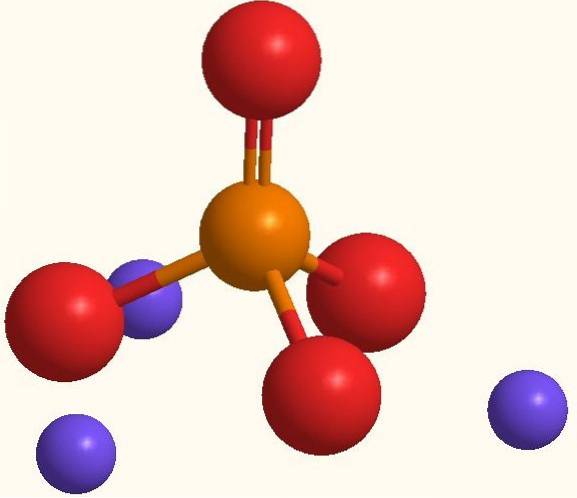
Ta sama formuła Na3PO4 wskazuje, że dla każdego anionu PO43- istnieją trzy kationy Na+. Jony te można zobaczyć na powyższym obrazku. Zwróć uwagę, że plik PO43- ma geometrię czworościenną, z atomami tlenu przenoszącymi rezonansowy ładunek ujemny, który przyciąga Na+ środowiska.
Podobnie formuła Na3PO4 zwraca uwagę, że jest to sól bezwodna, więc w jej kryształach nie ma cząsteczek wody. Przyciąganie elektrostatyczne między Na+ i PO43- w końcu definiują trygonalny biały kryształ. Jego wiązanie jonowe jest takie, że Na3PO4 ma temperaturę topnienia 1583 ° C, znacznie wyższą niż różne sole.
Zarówno Na+ jak PO43- Są to jony, które mogą być silnie uwodnione, bez negatywnego wpływu na stabilność kryształów.
Z tego powodu hydraty mogą również krystalizować; jednak jej temperatury topnienia są niższe niż w przypadku soli bezwodnej, ponieważ międzycząsteczkowe wiązania wodorowe w wodzie oddzielają jony i osłabiają ich wzajemne oddziaływanie. W Na3PO412HdwaLub, na przykład, jego temperatura topnienia wynosi 73,4 ° C, znacznie niższa niż temperatura topnienia Na3PO4.
Nieruchomości
Wygląd fizyczny
Może wyglądać jako określone białe kryształy lub jako proszek lub granulki tego samego koloru. Wszystkie podane poniżej wielkości fizyczne odnoszą się tylko do bezwodnej soli Na3PO4.
Temperatura topnienia
1583 ° C
Temperatura wrzenia
100 ºC
Rozpuszczalność w wodzie
14,5 g / 100 ml w temperaturze 25 ºC, dlatego uważa się, że jest to fosforan dobrze rozpuszczalny w wodzie. Jednak jest nierozpuszczalny w rozpuszczalnikach organicznych, takich jak etanol i dwusiarczek węgla..
Gęstość
2,536 g / cm3 w 17,5 ° C.
Stabilność
Jest higroskopijnym ciałem stałym. Dlatego należy go przechowywać w taki sposób, aby nie był narażony na działanie wilgoci.
pH
Jest to sól silnie zasadowa. Na przykład jej 0,1% wodny roztwór ma już pH 11,5. Ta właściwość służy jako dodatek do detergentów.
Synteza
Jak jest wytwarzany lub syntetyzowany fosforan sodu? Aby to zrobić, zaczynamy od kwasu fosforowego, H.3PO4, lub soli sodowej dikwasu fosforanu, NaHdwaPO4.
W zdecydowanej większości syntez H jest preferowany3PO4. W ten sposób H reaguje3PO4 z zasadą, która neutralizuje jego trzy grupy OH, biorąc pod uwagę, że kwas ten można również zapisać jako PO (OH)3.
Zasadą jest korzystnie wodorotlenek sodu, NaOH (w Niemczech), ale możliwe jest również (i tańsze) użycie węglanu sodu lub sody kalcynowanej NadwaWSPÓŁ3 (w Stanach Zjednoczonych). Równania dla obu reakcji neutralizacji są następujące:
NadwaWSPÓŁ3 + H.3PO4 → NadwaHPO4 + WSPÓŁdwa + H.dwaLUB
NadwaHPO4 + NaOH → Na3PO4 + H.dwaLUB
Zwróć uwagę, że używając NadwaWSPÓŁ3 Nie otrzymuje się Na3PO4 ale NadwaHPO4, które będą wymagały późniejszej neutralizacji. Ponieważ medium reakcyjne jest wodne, Na krystalizuje3PO412HdwaLub, więc musi być kalcynowany, aby usunąć zawartość wody i w ten sposób stworzyć bezwodną sól.
Następnie3PO412HdwaLub charakteryzuje się „stopieniem” kryształów w zwartą masę, którą trudno rozbić. Im mniejszy rozmiar twoich kryształów, tym szybsza będzie ich kalcynacja.
Aplikacje
jedzenie

W przypadku stosowania fosforanu sodu nieuniknione jest mieszanie Na3PO4 lub do Na3PO412HdwaLub, ponieważ ten ostatni jest najbardziej komercyjnym hydratem. Na przykład, jeden z nich dostarcza nieszkodliwe jony (w teorii) do żywności, do której są dodawane, wzbogacając je w fosforany i jednocześnie zwiększając ich zasolenie..
W soli mięsnej Na3PO412HdwaLub dołączone, aby zachować świeżość dłużej podczas przechowywania. Podobnie, dodaje się go jako środek emulgujący, tak że mieszanina oleju i wody nie „tnie”, ale raczej pozostaje zjednoczona; i jako regulator pH, ponieważ pomaga zmniejszyć kwasowość żywności (w tym zbóż).
Ponadto służy do zagęszczania niektórych sosów pomidorowych oraz do pieczenia ciast czy pieczywa (górne zdjęcie). To ostatnie jest spowodowane Na3PO412HdwaLub ma tendencję do uwalniania pary wodnej, co zwiększa rozmiar porów i objętość ciasta mącznego..
Detergenty
Fosforan sodu jest wystarczająco zasadowy, aby zmydlać niektóre tłuszcze lub oleje, z którymi się styka. Jego zasadowość jest następnie wykorzystywana do polepszenia działania detergentów, o ile odtłuszczana powierzchnia nie jest metaliczna, ponieważ mogą ją uszkodzić..
Jednak produkcja detergentów wzbogaconych fosforanami została ograniczona ze względu na eutrofizację jezior i rzek, a wraz z nią rozmnażanie się glonów pokrywających ich powierzchnie..
Został również użyty do zrobienia środka dezynfekującego: Na3PO41 / 4NaOCl11HdwaLub, który jest przygotowywany przy użyciu podchlorynu sodu, NaOCl, zamiast NaOH lub NadwaWSPÓŁ3 zneutralizować H.3PO4.
Leczniczy
Następnie3PO4 indukuje wypróżnianie działając jako hiperosmotyczny środek przeczyszczający, niezbędny do oczyszczenia okrężnicy przed wykonaniem kolonoskopii. Z drugiej strony znalazła również zastosowanie (dodawanie) w suplementach energetycznych.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Narodowe Centrum Informacji Biotechnologicznej. (2019). Fosforan trisodowy. Baza danych PubChem. CID = 24243. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Fosforan trisodowy. Odzyskane z: en.wikipedia.org
- Curran M.P. & Plosker G.L. (2004). Doustny roztwór fosforanu sodu: przegląd jego stosowania jako środka do oczyszczania jelita grubego. DOI: 10.2165 / 00003495-200464150-00009
- Corey Whelan. (22 grudnia 2017). Fosforan sodu. Odzyskany z: healthline.com
- Jacobs, Joel B. Taborosi, Steve. (2019). Proces produkcji fosforanu trójsodowego. Odzyskany z: freepatentsonline.com
- MaryAnn Marks. (2018). Dlaczego fosforan trójsodowy (TSP) jest dodawany do naszej żywności? Odzyskany z: theingredientguru.com


Jeszcze bez komentarzy