
Wzór molekularny, jak go zdobyć, przykłady i ćwiczenia
Plik formuła molekularna Jest to reprezentacja cząsteczki związku, w której atomy wszystkich pierwiastków obecnych w związku oraz ich liczba są oznaczone symbolami chemicznymi. Każdemu atomowi towarzyszy indeks dolny.
Wzór cząsteczkowy ma ograniczenie polegające na tym, że nie wskazuje wiązań różnych atomów cząsteczki ani ich relacji przestrzennych; jak formuła strukturalna. W niektórych przypadkach nie jest to specyficzne, na przykład: C6H.12LUB6 to wzór cząsteczkowy glukozy, galaktozy i fruktozy.
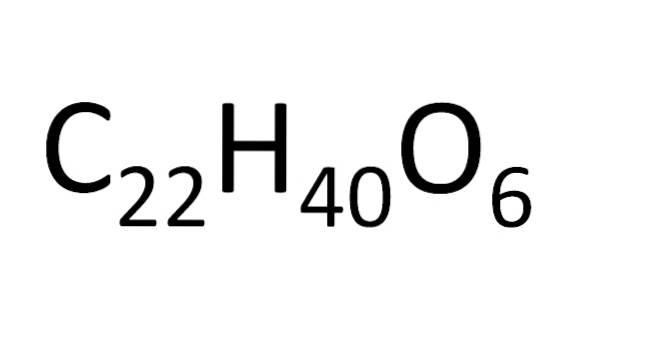
Istnieje zestaw reguł dotyczących ułożenia atomów we wzorze cząsteczkowym. W przypadku soli jonowych, na przykład chlorku sodu, symbol kationu (Na+), a następnie symbol anionu (Cl-). Dlatego wzór cząsteczkowy chlorku sodu to NaCl.
Wzór cząsteczkowy związków organicznych zapisuje się umieszczając najpierw symbol węgla (C), następnie symbol wodoru (H), a następnie pozostałe atomy. Na przykład wzór cząsteczkowy kwasu octowego to CdwaH.4LUBdwa.
Indeks artykułów
- 1 Jak uzyskać wzór cząsteczkowy
- 1.1 Pierwszy krok
- 1.2 Drugi krok
- 1.3 Trzeci krok
- 1.4 Czwarty krok
- 1.5 Piąty krok
- 2 Przykłady wzorów cząsteczkowych
- 3 ćwiczenia rozwiązane
- 3.1 - Ćwiczenie 1
- 3.2 - Ćwiczenie 2
- 4 Odnośniki
Jak uzyskać wzór cząsteczkowy
Uzyskanie wzoru cząsteczkowego związku opiera się na wcześniejszym ustaleniu jego minimum lub wzoru empirycznego. Z tego powodu początkowe kroki w celu uzyskania obu formuł są wspólne..
Pierwszy krok
Zwykle masę pierwiastków związku chemicznego wyraża się w postaci procentowej. Następnie należy przeprowadzić proste obliczenia, aby przekształcić procenty masowe różnych pierwiastków na ich masy wyrażone w gramach..
Drugi krok
Znając masę w gramach każdego z pierwiastków i ich masę atomową, względną liczbę każdego atomu lub liczbę moli każdego atomu można otrzymać, dzieląc masę każdego z różnych pierwiastków przez ich masę atomową..
Trzeci krok
Podzielić względne liczby wszyscy atomów, wprowadź względną liczbę mniejszej wartości. Wartości minimalnej proporcji muszą być liczbami całkowitymi. W przypadku, gdy wartość proporcji zawiera miejsce po przecinku, należy dokonać korekty, aby ta część dziesiętna zniknęła.
Korekta polega na pomnożeniu wszystkich wartości proporcji przez liczbę, która zwraca liczby całkowite do wszystkich wartości. Na przykład, jeśli wartość minimalnej proporcji wynosi 1,25, wszystkie wartości należy pomnożyć przez cztery (4). Ponieważ 1,25 razy 4 równa się 5, jest to liczba całkowita.
Czwarty krok
Wszystkie symbole chemiczne pierwiastków związku zostaną umieszczone wraz z odpowiadającym im indeksem dolnym; czyli wartość minimalnej proporcji elementu.
Piąty krok
Minimalny wzór związku można przekształcić w jego wzór cząsteczkowy, uzyskując stosunek masy cząsteczkowej związku do masy jego minimalnego wzoru (n). Ta zależność jest taka sama, jaka istnieje między wzorem cząsteczkowym a wzorem minimum.
n = masa cząsteczkowa związku / waga minimalnego wzoru
Aby otrzymać wzór cząsteczkowy, minimalny wzór należy pomnożyć przez n. Oznacza to, że każdy z dolnych wskaźników formuły minimum musi zostać pomnożony przez n.
n = masa cząsteczkowa / minimalna masa preparatu
= Wzór cząsteczkowy / Wzór minimalny
Formuła molekularna = nminimalna formuła
Przykłady wzorów cząsteczkowych
Poniżej wymieniono niektóre typowe wzory cząsteczkowe:
-Tlenek żelaza (FeO)
-Wodorotlenek Sodu (NaOH)
-Tlenek potasu (K.dwaLUB)
-Tlenek nadchlorowy (CldwaLUB7)
-Wodorotlenek żelazowy [Fe (OH)3]
-Chlorek wapnia (CaCldwa)
-Kwas solny (HCl)
-Siarczan sodu (Ndwapołudniowy zachód4)
-Kwas siarkowy (H.dwapołudniowy zachód4)
-Kwas nadbromowy (HBrO4)
-Chlorek glinu (AlCl3)
-Metan (CH4)
-Propan (C.3H.8)
-Etan (C.dwaH.6)
-Alkohol etylowy (C.dwaH.6LUB)
-Kwas octowy (C.dwaH.4LUBdwa)
-Benzen (C.6H.6)
-Glukoza (C.6H.12LUB6)
Rozwiązane ćwiczenia
- Ćwiczenie 1
Benzoesan metylu ma następujące procenty masowe:
C: 70,57%,
W: 5,93%
Lub: 23,49%
I o masie cząsteczkowej 136,1 g / mol. Określ wzór cząsteczkowy.
Pierwszy krok
Pierwszym krokiem jest wyrażenie procentów masowych pierwiastków w ich masach w gramach, wiedząc, że procenty masowe są w stosunku do masy cząsteczkowej..
Spośród 136,1 gramów odpowiadających molowi związku 70,57% stanowi tylko węgiel. I tak dalej z pozostałymi elementami:
Masa węgla = 136,1 g (70,57 / 100)
= 96,05 g
Masa wodoru = 136,1 g (5,93 / 100)
= 8,06 g
Masa tlenu = 136,1 (23,49 / 100)
= 31,96 g
Drugi krok
Przy opracowywaniu wzoru cząsteczkowego należy określić względną liczbę atomów (NRA). Aby to zrobić, masy pierwiastków są podzielone przez ich masy atomowe:
NRA (C) = 96 g / 12 g
= 8
NRA (H) = 8 g / 1 g
= 8 g
NRA (O) = 32 g / 16 g
= 2
Trzeci krok
Musimy wtedy obliczyć minimalne proporcje pierwiastków (PME). Aby to zrobić, wszystkie wartości NRA są podzielone przez najniższą wartość NRA:
PME (C) = 8/2
= 4
PME (H) = 8/2
= 4
PME (O) = 2/2
= 1
Czwarty krok
Napisz minimalny wzór na benzoesan metylu, biorąc pod uwagę fakt, że indeksy poszczególnych pierwiastków to ich obliczone minimalne proporcje:
do4H.4LUB
Piąty krok
Na koniec należy ustalić wzór cząsteczkowy benzoesanu metylu. Dlatego obliczamy n:
n = masa cząsteczkowa / minimalna masa preparatu
Waga minimalnej formuły to 68 g / mol:
= 136,1 g / 68 g
n ≈ 2
Formuła molekularna = 2 formuła minimalna
= 2 ° C4H.4LUB
Wzór cząsteczkowy benzoesanu metylu = do8H.8LUBdwa
- Ćwiczenie 2
Udział procentowy pierwiastków tworzących benzen jest następujący:
C: 92,36%
W: 7,64%.
Masa cząsteczkowa benzenu wynosi 78 g / mol. Określ swój wzór cząsteczkowy.
Pierwszy krok
Przekształć procenty masowe pierwiastków na ich masy w gramach:
Masa węgla = 78 g (92,36 / 100)
= 72,04 g
Masa wodoru = 78 g (7,64 / 100)
= 5,96 g
Drugi krok
Obliczanie względnej liczby atomów (NRA). Aby to zrobić, masy pierwiastków są podzielone przez ich masy atomowe:
NRA (C) = 72 g / 12 g
= 6
NRA (H) = 6 g / 1 g
= 6
Trzeci krok
Obliczanie wartości minimalnej proporcji pierwiastków (PME). Oblicza się to, dzieląc wartości NRA wszystkich pozycji przez najmniejszą wartość NRA:
PME (C) = 6/6
= 1
PME (H) = 6/6
= 1
Czwarty krok
Zapisując minimalny wzór na benzen, biorąc pod uwagę, że indeksami dolnymi pierwiastków są wartości minimalnej obliczonej proporcji.
Minimalna formuła benzenu: CH
Piąty krok
Ustalenie wzoru cząsteczkowego poprzez obliczenie zależności między masą cząsteczkową a masą minimalnego wzoru:
n = masa cząsteczkowa / masa formuły minimalnej
= 78 g / 13 g
n = 6
Wzór cząsteczkowy = nminimalny wzór
= 6CH
= do6H.6
Bibliografia
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning.
- Wikipedia. (2020). Wzór chemiczny. Odzyskane z: en.wikipedia.org
- Bezgraniczna nauka. (s.f.). Formuły molekularne. Odzyskany z: course.lumenlearning.com
- Helmenstine, dr Anne Marie (29 września 2019). Oblicz wzory empiryczne i molekularne. Odzyskany z: thinkco.com
- Peter J. Mikulecky, Chris Hren. (2020). Jak używać wzorów empirycznych do znajdowania wzorów molekularnych. Odzyskany z: dummies.com



Jeszcze bez komentarzy