
Półopracowana formuła, czym jest i przykłady (metan, propan, butan ...)

Plik pół rozwinięta formuła, Znany również jako wzór półstrukturalny, jest jednym z wielu możliwych przedstawień, które można nadać cząsteczce związku. Jest bardzo powtarzalny w chemii organicznej, zwłaszcza w tekstach akademickich, ponieważ pokazuje prawidłowe uporządkowanie cząsteczki i jej wiązań kowalencyjnych.
W przeciwieństwie do opracowanego wzoru, który jest taki sam jak wzór strukturalny, ten nie pokazuje wiązań C-H, pomijając je dla uproszczenia reprezentacji. Na podstawie tego wzoru każdy czytelnik będzie w stanie zrozumieć, czym jest kręgosłup cząsteczki; ale nie jego geometria ani żaden z aspektów stereochemicznych.
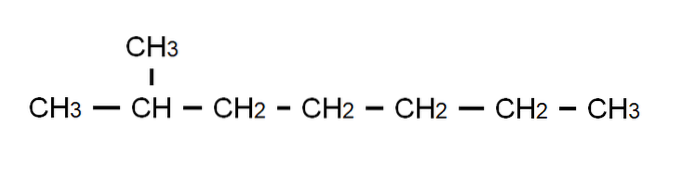
Aby wyjaśnić ten punkt, mamy powyżej częściowo rozwiniętego wzoru 2-metyloheptanu: rozgałęzionego alkanu, którego wzór cząsteczkowy to C8H.18, i to jest zgodne z ogólnym wzorem C.nH.2n + 2. Zwróć uwagę, że wzór cząsteczkowy nie mówi absolutnie nic o strukturze, podczas gdy częściowo opracowany wzór pozwala nam wizualizować, jaka jest ta struktura..
Należy również zauważyć, że pominięto wiązania C-H, podkreślając tylko wiązania C-C, które tworzą łańcuch węglowy lub szkielet. Okaże się, że dla prostych cząsteczek opracowany wzór pokrywa się ze wzorem skondensowanym; a nawet z cząsteczką.
Indeks artykułów
- 1 Przykłady
- 1.1 Metan
- 1.2 Propan
- 1.3 Butan
- 1,4 Pentan
- 1,5 Etanol
- 1,6 Eter dimetylowy
- 1,7 Cykloheksan
- 1.8 Kwas fosforowy
- 2 Uwaga ogólna
- 3 Odnośniki
Przykłady
Metan
Wzór cząsteczkowy metanu to CH4, ponieważ ma cztery wiązania C-H i ma geometrię czworościenną. Dane te są dostarczane przez wzór strukturalny z klinami na zewnątrz lub poniżej płaszczyzny. W przypadku metanu wzór skondensowany staje się również CH4, a także empiryczne i częściowo rozwinięte. To jedyny związek, dla którego ta wyjątkowość jest spełniona..
Powodem częściowo rozwiniętej formuły metanu jest CH4, dzieje się tak, ponieważ ich wiązania C-H nie są zapisane; byłoby to zgodne z wzorem strukturalnym.
Propan
Częściowo opracowana formuła propanu to CH3-CHdwa-CH3, posiadające tylko dwa wiązania C-C. Jego cząsteczka jest liniowa, a jeśli ją zauważysz, jej skondensowany wzór jest dokładnie taki sam: CH3CHdwaCH3, jedyną różnicą jest to, że pomija się wiązania C-C. W przypadku propanu prawdą jest, że zarówno formuła częściowo rozwinięta, jak i skondensowana pokrywają się.
W rzeczywistości jest to prawdą dla wszystkich alkanów o łańcuchu liniowym, co będzie nadal widoczne w następnych rozdziałach.
Butan
Pół rozwinięta formuła butanu to CH3-CHdwa-CHdwa-CH3. Zwróć uwagę, że można go zapisać w tej samej linii. Ta formuła ściśle odpowiada formule n-butan, co wskazuje, że jest to izomer liniowy i nierozgałęziony. Rozgałęziony izomer, 2-metylopropan, ma następujący częściowo rozwinięty wzór:
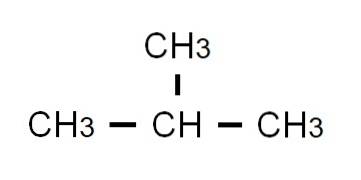
Tym razem nie można go już zapisać ani przedstawić w tej samej linii. Te dwa izomery mają ten sam wzór cząsteczkowy: C4H.10, co nie służy do odróżniania jednego od drugiego.
Pentan
Znów mamy inny alkan: pentan, którego wzór cząsteczkowy to C.5H.12. Na wpół rozwinięta formuła n-pentan to CH3-CHdwa-CHdwa-CHdwa-CH3, łatwe do przedstawienia i zinterpretowania, bez konieczności umieszczania linków C-H. Grupy CH3 nazywane są metylami lub metylami i CHdwa są metylenami.
Pentan ma inne rozgałęzione izomery strukturalne, które można zobaczyć na dolnym obrazie reprezentowanym przez ich odpowiednie pół-rozwinięte wzory:
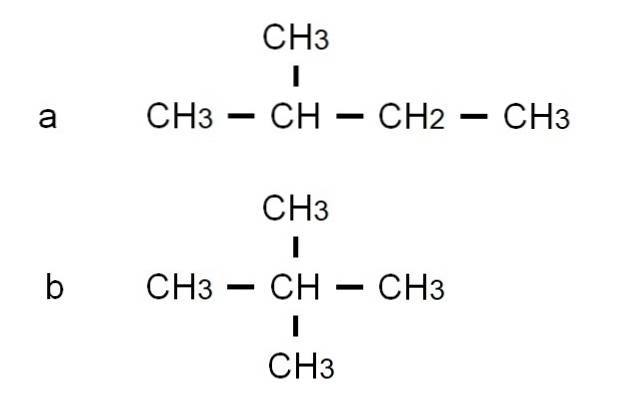
Izomer do to 2-metylobutan, zwany także izopentanem. Tymczasem izomer b to 2,2-dimetylopropan, znany również jako neopentan. Jego częściowo rozwinięte formuły sprawiają, że różnica między tymi dwoma izomerami jest jasna; Ale nie mówi wiele o tym, jak takie cząsteczki wyglądałyby w kosmosie. W tym celu potrzebne byłyby wzory i modele strukturalne.
Etanol
Półopracowane formuły są stosowane nie tylko do alkanów, alkenów lub alkinów, ale do każdego rodzaju związków organicznych. Tak więc etanol, alkohol, ma częściowo rozwinięty wzór: CH3-CHdwa-O. Zauważ, że teraz reprezentowane jest wiązanie C-O, ale nie wiązanie O-H. Wszystkie wiązania wodorowe są zaniedbane.
Alkohole liniowe są łatwe do przedstawienia, podobnie jak alkany. Krótko mówiąc: wszystkie częściowo opracowane wzory na cząsteczki liniowe są łatwe do napisania.
Eter dimetylowy
Etery można również przedstawić za pomocą częściowo rozwiniętych formuł. W przypadku eteru dimetylowego, którego wzór cząsteczkowy to CdwaH.6Lub częściowo rozwinięte staje się: CH3-O-CH3. Zauważ, że eter dimetylowy i etanol są izomerami strukturalnymi, ponieważ mają ten sam wzór cząsteczkowy (policz atomy C, H i O).
Cykloheksan
Na wpół rozwinięte wzory na związki rozgałęzione są trudniejsze do przedstawienia niż wzory liniowe; ale jeszcze bardziej są to związki cykliczne, takie jak cykloheksan. Jego wzór cząsteczkowy jest taki sam jak dla heksenu i jego izomerów strukturalnych: C6H.12, ponieważ sześciokątny pierścień liczy się jako nienasycenie.
Aby przedstawić cykloheksan, narysowano sześciokątny pierścień, na którego wierzchołkach będą znajdować się grupy metylenowe, CHdwa, tak jak widać poniżej:
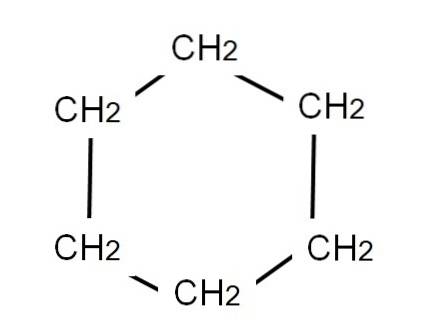
Opracowany wzór cykloheksanu wykazywałby wiązania C-H, tak jakby pierścień miał telewizyjne „anteny”.
Kwas fosforowy
Wzór cząsteczkowy kwasu fosforawego to H.3PO3. W przypadku wielu związków nieorganicznych wystarczy wzór cząsteczkowy, aby zorientować się w ich budowie. Ale jest kilka wyjątków i to jest jeden z nich. Z tym, że H3PO3 jest kwasem diprotycznym, częściowo rozwinięta formuła to: HPO (OH)dwa.
Oznacza to, że jeden z wodorów jest bezpośrednio przyłączony do atomu fosforu. Jednak formuła H3PO3 dopuszcza również cząsteczkę o częściowo rozwiniętej formule: PO (OH)3. Oba są w rzeczywistości tak zwanymi tautomerami.
Pół rozwinięte formuły w chemii nieorganicznej są bardzo podobne do skondensowanych formuł w chemii organicznej. W związkach nieorganicznych, ponieważ nie mają wiązań C-H, a ponieważ są w zasadzie prostsze, do ich opisu zwykle wystarczają ich wzory cząsteczkowe (gdy są związkami kowalencyjnymi).
Ogólny komentarz
Pół rozwinięte formuły są bardzo powszechne, gdy uczeń poznaje zasady nomenklatury. Ale po zasymilowaniu nuty chemiczne są na ogół zapchane wzorami strukturalnymi typu szkieletowego; to znaczy nie tylko pomijane są łącza C-H, ale także oszczędza się czas, ignorując C.
Co do reszty, formuły skondensowane są bardziej powtarzalne w chemii organicznej niż pół rozwinięte, ponieważ te pierwsze nie muszą nawet zapisywać linków, jak w drugiej. A jeśli chodzi o chemię nieorganiczną, te półopracowane formuły są rzadziej stosowane..
Bibliografia
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning.
- Wikipedia. (2020). Pół rozwinięta formuła. Odzyskane z: es.wikipedia.org
- Siyavula. (s.f.). Organiczne struktury molekularne. Odzyskany z: siyavula.com
- Jean Kim i Kristina Bonnett. (05 czerwca 2019). Rysowanie struktur organicznych. Chemistry Libretexts. Źródło: chem.libretexts.org
- Nauczyciele. MARL i JLA. (s.f.). Wprowadzenie do związków węgla. [PDF]. Odzyskany z: ipn.mx
Jeszcze bez komentarzy