
Charakterystyka, budowa, funkcje śluzówki
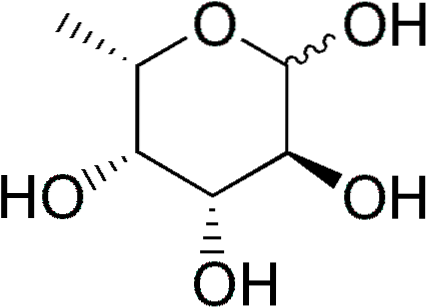
Plik fukoza (w skrócie Fuc) lub 6-L-deoksy-galaktoza, jest częściowo odtlenionym (deoksysugar) sześciowęglowym monosacharydem, którego wzór empiryczny to C6H.12LUB5. Podobnie jak inne cukry proste, jest cukrem wielowodorotlenowym.
Gdy grupa hydroksylowa jest zastąpiona atomem wodoru, powstaje dezoksysugar. Chociaż teoretycznie ta zamiana może wpłynąć na dowolną grupę hydroksylową dowolnego monosacharydu, w naturze występuje niewielka różnorodność dezoksysugarów.
Niektóre deoksysugary to: 1) deoksyryboza (2-deoksy-D-ryboza), pochodząca z D-rybozy, która jest częścią DNA; 2) ramnoza (6-D-deoksymannoza), pochodząca z D-mannozy; 3) fukozy, pochodzącej z L-galaktozy. Ta ostatnia jest bardziej powszechna niż D-fukoza, pochodząca z D-galaktozy.
Indeks artykułów
- 1 Charakterystyka i struktura
- 2 Dystrybucja w przyrodzie
- 3 Metabolizm fukozy
- 4 Funkcje
- 4.1 Rola w raku
- 4.2 Rola w innych chorobach
- 4.3 Potencjał biomedyczny
- 5 Referencje
Charakterystyka i struktura
Fukoza jest również znana pod nazwami 6-deoksy-galakto-heksoza, fukopiranoza, galaktometyloza i rodeoza..
Chociaż normalnie występuje w tworzeniu polisacharydów i glikoprotein, izolowany jako monosacharyd, jest słodszy niż galaktoza. Wynika to z faktu, że zastąpienie grupy hydroksylowej atomem wodoru zwiększa hydrofobowość, a tym samym słodycz cząsteczki..
Grupy hydroksylowe fukozy mogą ulegać takim samym reakcjom jak inne cukry, wytwarzając szeroką gamę acetali, glikozydów, eterów i estrów..
Fukozylowana biocząsteczka to taka, do której w wyniku działania fukozylotransferazy zostały przyłączone cząsteczki fukozy poprzez wiązania glikozydowe. Gdy hydroliza wiązań glikozydowych zachodzi w wyniku działania fukozydazy, oddzielając w ten sposób fukozy, mówi się, że biocząsteczka została defukozylowana.
Gdy glukany są fukozylowane, generowane są bardziej złożone glukany zwane fukanami, które mogą, ale nie muszą być częścią glikoprotein. Siarczanowane fukany definiuje się jako te polisacharydy, które zawierają siarczanowane reszty L-fukozy. Są typowe dla brunatnic. Przykłady obejmują askofilan, sargasan i pelvetan..
Jednym z najlepiej przebadanych fukanów jest fukoidan, pozyskiwany z brunatnic Fucus vesiculosus, który jest sprzedawany (Sigma-Aldrich Chemical Company) od dziesięcioleci.
Dystrybucja w przyrodzie
D-fukoza jest obecna w antybiotykach wytwarzanych przez drobnoustroje oraz w glikozydach roślinnych, takich jak konwulina, chartreuzyna, ledienozyd i keirotoksyna.
L-fukoza jest składnikiem polisacharydów z alg, liści śliwki, lnu, soi i nasion rzepaku, gumy tragakantowej, ścian komórek ziemniaka, bulw manioku, kiwi, kory ceiba i mucigel kaliptry kukurydzianej, a także inne rośliny.
L-fukoza jest również obecna w jajach jeżowca oraz w żelatynie, która chroni jaja żab.
U ssaków fukany z L-fukozą tworzą ligandy, które działają na adhezję leukocytów i śródbłonka za pośrednictwem selektyny i biorą udział w licznych zdarzeniach ontogenetycznych.
L-fukoza jest bogata w fukosfingolipidy nabłonka przewodu pokarmowego i szpiku kostnego i występuje w małych ilościach w strukturach chrzęstnych i keratynowych.
U ludzi fukany L-fukozy są częścią glikoprotein w ślinie i sokach żołądkowych. Są również częścią antygenów definiujących grupy krwi ABO. Są obecne w różnych oligosacharydach w mleku matki.
Metabolizm fukozy
Fukozylotransferazy wykorzystują GDP-fukozę, aktywowaną nukleotydami formę fukozy, jako dawcę fukozy w budowie fukozylowanych oligosacharydów.
GDP-fukoza jest otrzymywana z GDP-mannozy przez kolejne działanie dwóch enzymów: 4,6-dehydratazy GDP-mannozy i 3,5-epimerazy-4-reduktazy GDP-4-keto-6-deoksymanozy.
Wykorzystując kofaktor NADP +, pierwszy enzym katalizuje odwodnienie GDP-mannozy. Redukcja pozycji 6 i utlenianie pozycji 4 daje GDP-6-deoksy-4-keto-mannozę (podczas reakcji hybryda jest przenoszona z pozycji 4 do 6 cukru).
Drugi enzym, który jest zależny od NADPH, katalizuje epimeryzację pozycji 3 i 5 oraz redukcję grupy 4-keto w GDP-6-deoksy-4-keto-mannozie..
Bakterie mogą rosnąć przy użyciu fukozy jako jedynego źródła węgla i energii za pomocą indukowanego przez fukozy operonu, który koduje enzymy kataboliczne tego cukru..
Powyższy proces obejmuje: 1) wejście wolnej fukozy przez ścianę komórkową za pośrednictwem permeazy; 2) izomeryzacja fukozy (aldozy) z wytworzeniem fukozy (ketoza); 3) fosforylacja fukulozy z wytworzeniem fuukulozo-1-fosforanu; 4) reakcja aldolazy w celu wytworzenia aldehydu mlekowego i fosforanu dihydroksyacetonu z fukulozo-1-fosforanu.
funkcje
Rola w raku
Objawy wielu typów guzów nowotworowych obejmują obecność białek związanych z glukanem, które wyróżniają się zmienionym składem oligosacharydów. Obecność tych nieprawidłowych glukanów, wśród których wyróżniają się fukany, jest związana ze złośliwością i potencjałem przerzutowym tych guzów.
W raku piersi komórki nowotworowe włączają fukozy do glikoprotein i glikolipidów. Fukoza przyczynia się do progresji tego raka, sprzyjając aktywacji nowotworowych komórek macierzystych, hematogennym przerzutom i inwazji nowotworów przez macierze zewnątrzkomórkowe.
W raku płuc i hepatokarcynogenezie zwiększona ekspresja fukozy wiąże się z wysokim potencjałem przerzutów i niskim prawdopodobieństwem przeżycia.
W przeciwieństwie do tego, niektóre siarczanowane fukany są obiecującymi substancjami w leczeniu raka, jak ustalono w licznych badaniach in vitro na liniach komórek rakowych, w tym tych, które powodują raka piersi, płuc, prostaty, żołądka, okrężnicy i odbytnicy..
Rola w innych chorobach
Zwiększona ekspresja fukanów w immunoglobulinach surowicy była związana z reumatoidalnym zapaleniem stawów w wieku młodzieńczym i dorosłym.
Niedobór adhezji leukocytów II jest rzadką wrodzoną chorobą spowodowaną mutacjami, które zmieniają aktywność transportera FDP-fukozy zlokalizowanego w aparacie Golgiego.
Pacjenci cierpią na upośledzenie umysłowe i psychomotoryczne oraz cierpią na nawracające infekcje bakteryjne. Ta choroba dobrze reaguje na doustne dawki fukozy.
Potencjał biomedyczny
Fukany siarczanowe otrzymywane z brunatnic są ważnym rezerwuarem związków o potencjale terapeutycznym.
Działają przeciwzapalnie i przeciwutleniająco, hamując migrację limfocytów w miejscach infekcji i sprzyjając uwalnianiu cytokin. Zwiększyć odpowiedź immunologiczną poprzez aktywację limfocytów i makrofagów.
Posiadają właściwości przeciwzakrzepowe. Wykazano, że po podaniu doustnym hamuje agregację płytek krwi u ludzi.
Mają potencjał antybiotyczny i przeciwpasożytniczy oraz hamują rozwój bakterii chorobotwórczych żołądka Helicobacter pylori. Zabij pasożyty Plasmodium spp. (czynnik wywołujący malarię) i Leishmania donovani (czynnik sprawczy amerykańskiej leiszmaniozy wiscerotropowej).
Wreszcie mają silne właściwości przeciwwirusowe, hamując przedostawanie się do komórki kilku wirusów o dużym znaczeniu dla zdrowia ludzkiego, w tym Arenavirus, Wirus cytomegalii, Hantavirus, Hepadnavirus, HIV, wirus opryszczki pospolitej i wirus grypy.
Bibliografia
- Becker, D. J., Lowe, J. B. 2003. Fukoza: biosynteza i funkcja biologiczna u ssaków. Glycobiology, 13, 41R-53R.
- Deniaud-Bouët, E., Hardouin, K., Potin, P., Kloareg, B., Hervé, C. 2017. Przegląd ścian komórkowych brązowych alg i siarczanowanych polisacharydów zawierających fukozę: kontekst ściany komórkowej, właściwości biomedyczne i klucz wyzwania badawcze Carbohydrate Polymers, http://dx.doi.org/10.1016/j.carbpol.2017.07.082.
- Flowers H. M. 1981. Chemia i biochemia D- i L-fukozy. Advances in Carbohydrate Chemistry and Biochemistry, 39, 279-345.
- Listinsky, J. J., Siegal, G. P., Listinsky, C. M. 2011. The emerging weight of α-Fukoza L w ludzkim raku piersi: przegląd. Am. J. Transl. Res., 3, 292–322.
- Murray, R. K., i in. 2003. Ilustrowana biochemia Harpera. McGraw-Hill, Nowy Jork.
- Pereira, L. 2018. Terapeutyczne i odżywcze zastosowania alg. CRC Press, Boca Raton.
- Staudacher, E., Altmann, F., Wilson, I. B. H., März, L. 1999. Fukoza w N-glikanach: od rośliny do człowieka. Biochimica et Biophysica Acta, 1473, 216-236.
- Tanner, W., Loewus, F. A. 1981. Węglowodany roślinne II. Węglowodany zewnątrzkomórkowe. Springer, Nowy Jork.
- Vanhooren, P. T., Vandamme, E. J. 1999. L-fukozy: występowanie, rola fizjologiczna, synteza chemiczna, enzymatyczna i mikrobiologiczna. Journal of Chemical Technology and Biotechnology, 74, 479–497.



Jeszcze bez komentarzy