
Rodzaje, procesy i funkcje glikozylacji białek

Plik glikozylacja białek Jest to modyfikacja potranslacyjna polegająca na dodaniu do białka liniowych lub rozgałęzionych łańcuchów oligosacharydowych. Powstałe glikoproteiny są na ogół białkami powierzchniowymi i białkami szlaku wydzielniczego..
Glikozylacja jest jedną z najczęstszych modyfikacji peptydów wśród organizmów eukariotycznych, ale wykazano, że występuje również u niektórych gatunków archeonów i bakterii..
U eukariotów mechanizm ten zachodzi między retikulum endoplazmatycznym (ER) a kompleksem Golgiego, przy interwencji różnych enzymów zaangażowanych zarówno w procesy regulacyjne, jak i w tworzenie wiązań kowalencyjnych białko + oligosacharyd..
Indeks artykułów
- 1 Rodzaje glikolizy
- 1.1 N-glikozylacja
- 1.2 O-glikozylacja
- 1.3 C-mannozylacja
- 1.4 Glypiation (z angielskiego „Glypiation”)
- 2 Proces
- 2.1 U eukariontów
- 2.2 U prokariotów
- 3 Funkcje
- 3.1 Znaczenie
- 4 Odnośniki
Rodzaje glikolizy
W zależności od miejsca wiązania oligosacharydu z białkiem glikozylację można podzielić na 4 typy:
N-glikozylacja
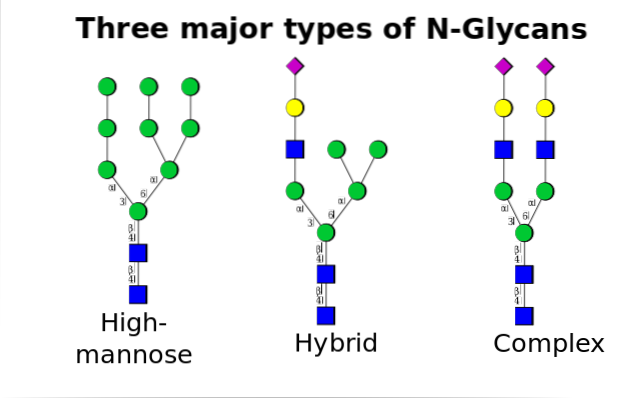
Jest to najpowszechniejsze ze wszystkich i występuje, gdy oligosacharydy wiążą się z azotem grupy amidowej reszt asparaginy w motywie Asn-X-Ser / Thr, gdzie X może być dowolnym aminokwasem oprócz proliny.
LUB-glikozylacja
Kiedy węglowodany są przyłączone do grupy hydroksylowej seryny, treoniny, hydroksylizyny lub tyrozyny. Jest to mniej powszechna modyfikacja i są przykładami białek, takich jak kolagen, glikoforyna i mucyny..
do-mannozylacja
Polega na dodaniu reszty mannozy, która wiąże się z białkiem wiązaniem C-C z C2 grupy indolowej w resztach tryptofanu.
Glipiation (z angielskiego „Glypiation ”)
Polisacharyd działa jako mostek łączący białko z kotwicą glikozylofosfatydyloinozytolu (GPI) na błonie.
Proces
U eukariotów
Plik N-bardziej szczegółowo zbadano glikozylację. W komórkach ssaków proces rozpoczyna się w szorstkim ER, gdzie wstępnie uformowany polisacharyd wiąże się z białkami, które wyłaniają się z rybosomów..
Wspomniany polisacharyd prekursorowy składa się z 14 reszt cukrowych, a mianowicie: 3 reszt glukozy (Glc), 9 mannozy (Man) i 2 reszt N-acetyloglukozaminy (GlcNAc).
Ten prekursor jest powszechny w roślinach, zwierzętach i jednokomórkowych organizmach eukariotycznych. Wiąże się z błoną dzięki wiązaniu z cząsteczką dolicholu, izoprenoidowym lipidem osadzonym w błonie ER..
Po jego syntezie oligosacharyd jest przenoszony przez kompleks enzymatyczny oligosakrylotransferazy do reszty asparaginy zawartej w sekwencji trójpeptydowej Asn-X-Ser / Thr białka podczas translacji.
Trzy reszty Glc na końcu oligosacharydu służą jako sygnał do prawidłowej syntezy oligosacharydów i są odszczepiane razem z jedną z reszt Man przed przeniesieniem białka do aparatu Golgiego w celu dalszej obróbki..
Po umieszczeniu w aparacie Golgiego części oligosacharydów przyłączone do glikoprotein można modyfikować przez dodanie galaktozy, kwasu sialowego, fukozy i wielu innych reszt, uzyskując łańcuchy o znacznie większej różnorodności i złożoności..
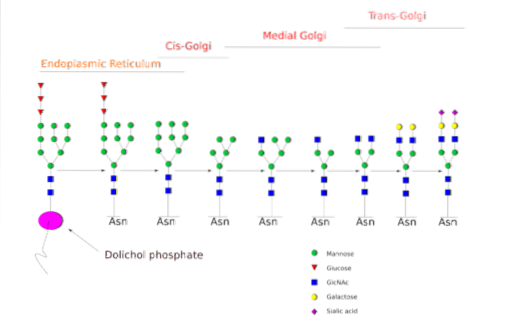
Mechanizm enzymatyczny potrzebny do przeprowadzenia procesów glikozylacji obejmuje liczne glikozylotransferazy do dodawania cukrów, glikozydazy do ich usuwania oraz różne nukleotydowe transportery cukrów do udziału reszt stosowanych jako substraty..
U prokariotów
Bakterie nie mają wewnątrzkomórkowych układów błonowych, więc powstanie początkowego oligosacharydu (tylko 7 reszt) zachodzi po cytozolowej stronie błony komórkowej..
Wspomniany prekursor jest syntetyzowany na lipidzie, który jest następnie przemieszczany przez flapazę zależną od ATP do przestrzeni peryplazmatycznej, gdzie zachodzi glikozylacja..
Inną ważną różnicą między glikozylacją eukariotyczną i prokariotyczną jest to, że enzym transferazy oligosacharydowej (oligosacarylotransferaza) z bakterii może przenosić reszty cukrowe do wolnych części już zwiniętych białek, a nie podczas translacji przez rybosomy..
Ponadto motyw peptydowy rozpoznawany przez ten enzym nie jest tą samą eukariotyczną sekwencją trójpeptydową..
funkcje
Plik N-oligosacharydy przyłączone do glikoprotein służą różnym celom. Na przykład, niektóre białka wymagają tej potranslacyjnej modyfikacji, aby uzyskać właściwe fałdowanie swojej struktury..
W przypadku innych zapewnia stabilność, albo poprzez unikanie degradacji proteolitycznej, albo dlatego, że ta część jest niezbędna do spełnienia ich funkcji biologicznej..
Ponieważ oligosacharydy mają silny charakter hydrofilowy, ich kowalencyjne dodanie do białka z konieczności modyfikuje jego polarność i rozpuszczalność, co może mieć znaczenie z funkcjonalnego punktu widzenia..
Po przyłączeniu do białek błonowych oligosacharydy są cennymi nośnikami informacji. Uczestniczą w procesach sygnalizacji, komunikacji, rozpoznawania, migracji i adhezji komórek.
Odgrywają ważną rolę w krzepnięciu krwi, gojeniu i odpowiedzi immunologicznej, a także w przetwarzaniu kontroli jakości białka, która jest zależna od glikanów i niezbędna komórce..
Znaczenie
Co najmniej 18 chorób genetycznych zostało powiązanych z glikozylacją białek u ludzi, z których niektóre wiążą się ze słabym rozwojem fizycznym i umysłowym, podczas gdy inne mogą być śmiertelne.
Istnieje coraz więcej odkryć związanych z chorobami glikozylacji, zwłaszcza u pacjentów pediatrycznych. Wiele z tych zaburzeń jest wrodzonych i ma związek z wadami związanymi z początkowymi etapami tworzenia się oligosacharydów lub z regulacją enzymów uczestniczących w tych procesach..
Ponieważ duża część glikozylowanych białek tworzy glikokaliks, rośnie zainteresowanie weryfikacją, czy mutacje lub zmiany w procesach glikozylacji mogą być związane ze zmianami w mikrośrodowisku komórek nowotworowych, a tym samym sprzyjają progresji nowotworów i rozwojowi przerzuty u pacjentów z rakiem.
Bibliografia
- Aebi, M. (2013). N-glikozylacja białek w ER. Biochimica et Biophysica Acta, 1833(11), 2430-2437.
- Dennis, J. W., Granovsky, M. i Warren, C. E. (1999). Glikozylacja białek w rozwoju i chorobie. BioEssays, dwadzieścia jeden(5), 412-421.
- Lodish, H., Berk, A., Kaiser, C. A., Krieger, M., Bretscher, A., Ploegh, H.,… Martin, K. (2003). Molecular Cell Biology (Wyd. 5). Freeman, W. H. & Company.
- Luckey, M. (2008). Biologia strukturalna błony: na podstawach biochemicznych i biofizycznych. Cambridge University Press. Pobrane z www.cambrudge.org/9780521856553
- Nelson, D. L. i Cox, M. M. (2009). Zasady Lehningera biochemii. Wydania Omega (Wyd. 5).
- Nothaft, H., & Szymanski, C. M. (2010). Glikozylacja białek u bakterii: słodsza niż kiedykolwiek. Nature Recenzje Mikrobiologia, 8(11), 765-778.
- Ohtsubo, K. i Marth, J. D. (2006). Glikozylacja w komórkowych mechanizmach zdrowia i chorób. Komórka, 126(5), 855-867.
- Spiro, R. G. (2002). Glikozylacja białek: natura, dystrybucja, tworzenie enzymów i implikacje chorobowe wiązań glikopeptydowych. Glycobiology, 12(4), 43R-53R.
- Stowell, S. R., Ju, T., & Cummings, R. D. (2015). Glikozylacja białek w raku. Roczny przegląd patologii: mechanizmy choroby, 10(1), 473-510.
- Strasser, R. (2016). Glikozylacja białek roślinnych. Glycobiology, 26(9), 926-939.
- Xu, C. i Ng, D. T. W. (2015). Kontrola jakości fałdowania białek ukierunkowana na glikozylację. Nature Reviews Molecular Cell Biology, 16(12), 742-752.
- Zhang, X. i Wang, Y. (2016). Kontrola jakości glikozylacji za pomocą struktury Golgiego. Journal of Molecular Biology, 428(16), 3183-3193.


Jeszcze bez komentarzy