
Charakterystyka grup karbonylowych, właściwości, nazewnictwo, reaktywność
Plik grupa karbonylowa Jest to organiczna i utleniona grupa funkcyjna, która przypomina cząsteczkę gazowego tlenku węgla. Jest przedstawiany jako C = O i chociaż jest uważany za organiczny, można go również znaleźć w związkach nieorganicznych; jako kwas węglowy, HdwaWSPÓŁ3, lub w związkach metaloorganicznych z CO jako spoiwem.
Jednak to właśnie w chemii węgla, życiu, biochemii i innych podobnych gałęziach nauki grupa ta wyróżnia się ogromnym znaczeniem. Gdyby nie on, wiele cząsteczek nie byłoby w stanie wchodzić w interakcje z wodą; białka, cukry, aminokwasy, tłuszcze, kwasy nukleinowe i inne biocząsteczki nie istniałyby, gdyby nie on.
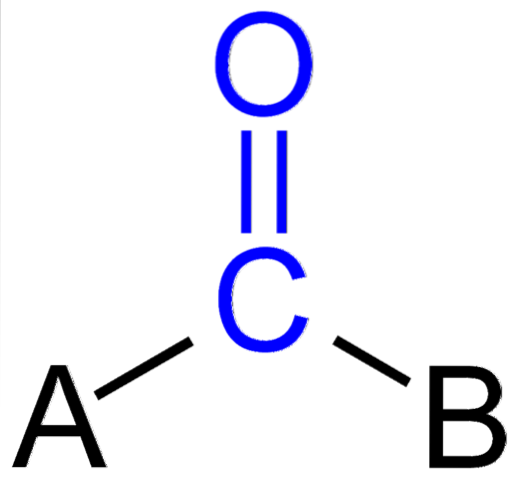
Powyższy obrazek pokazuje, jak ta grupa wygląda w ogólnym szkielecie związku. Zwróć uwagę, że jest on podkreślony niebieskim kolorem i gdybyśmy usunęli podstawniki A i B (R lub R ', równie ważne), cząsteczka tlenku węgla pozostałaby. Obecność tych podstawników definiuje dużą liczbę cząsteczek organicznych.
Jeśli A i B są atomami innymi niż węgiel, takimi jak metale lub pierwiastki niemetaliczne, to można mieć odpowiednio związki metaloorganiczne lub nieorganiczne. W przypadku chemii organicznej podstawniki A i B zawsze będą atomami wodoru, łańcuchami węglowymi, liniami z rozgałęzieniami lub bez, pierścieniami cyklicznymi lub aromatycznymi..
W ten sposób zaczyna się rozumieć, dlaczego grupa karbonylowa jest dość powszechna dla tych, którzy studiują nauki przyrodnicze lub o zdrowiu; jest wszędzie i bez niej mechanizmy molekularne zachodzące w naszych komórkach nie wystąpiłyby.
Gdyby można było podsumować jego znaczenie, można by powiedzieć, że przyczynia się do polarności, kwasowości i reaktywności cząsteczki. Tam, gdzie jest grupa karbonylowa, jest więcej niż prawdopodobne, że właśnie w tym momencie cząsteczka może przejść transformację. Dlatego jest to strategiczne miejsce do rozwoju syntezy organicznej poprzez utlenianie lub ataki nukleofilowe..
Indeks artykułów
- 1 Charakterystyka i właściwości grupy karbonylowej
- 1.1 Struktury rezonansowe
- 2 Nazewnictwo
- 3 Reaktywność
- 3.1 Atak nukleofilowy
- 3.2 Redukcja
- 3.3 Tworzenie acetali i ketali
- 4 rodzaje
- 5 Jak rozpoznać go w aldehydach i ketonach
- 5.1 Identyfikacja
- 6 Główne przykłady
- 7 Referencje
Charakterystyka i właściwości grupy karbonylowej
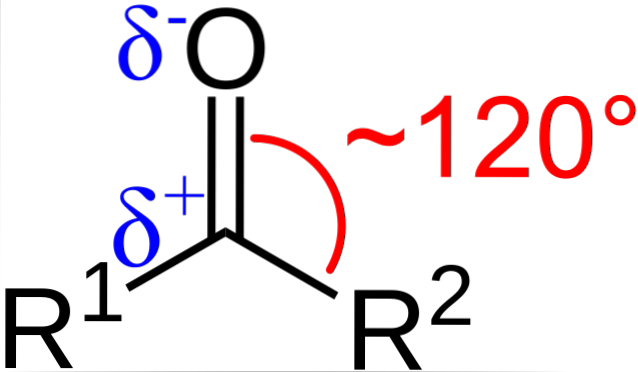
Jakie są strukturalne i elektroniczne właściwości grupy karbonylowej? Powyżej można zobaczyć, teraz używając liter R1 i R.dwa zamiast A i B istnieje kąt 120 ° C między podstawnikami a atomem tlenu; to znaczy, geometria wokół tej grupy jest płaszczyzną trygonalną.
Aby taka geometria była atomami węgla i tlenu, musi koniecznie mieć hybrydyzację chemiczną spdwa; tak więc węgiel będzie miał trzy orbitale spdwa tworząc proste wiązania kowalencyjne z R1 i R.dwa, i orbital p czysty, aby ustanowić podwójne wiązanie z tlenem.
To wyjaśnia, jak może istnieć podwójne wiązanie C = O.
Jeśli obserwuje się obraz, widać również, że tlen ma wyższą gęstość elektronową, δ-, niż węgiel, δ +. Wynika to z faktu, że tlen jest bardziej elektroujemny niż węgiel i dlatego „pozbawia” go gęstości elektronowej; i nie tylko on, ale także podstawniki R1 i R.dwa.
W konsekwencji generowany jest trwały moment dipolowy, który może mieć większą lub mniejszą wielkość w zależności od struktury molekularnej. Gdziekolwiek jest grupa karbonylowa, będą momenty dipolowe.
Struktury rezonansowe
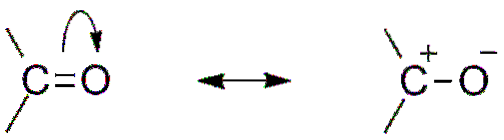
Inną konsekwencją elektroujemności tlenu jest to, że w grupie karbonylowej znajdują się struktury rezonansowe, które definiują hybrydę (połączenie dwóch struktur na górnym obrazie). Zauważ, że para elektronów może migrować w kierunku orbitalu p tlen, który opuszcza atom węgla z dodatnim częściowym ładunkiem; karbokacja.
Obie struktury nieustannie następują po sobie, więc węgiel ma stały niedobór elektronów; to znaczy, że kationy, które są bardzo blisko niej, będą doświadczać odpychania elektrostatycznego. Ale jeśli jest to anion lub gatunek zdolny do przekazywania elektronów, poczujesz silne przyciąganie do tego węgla..
Następnie dochodzi do tak zwanego ataku nukleofilowego, co zostanie wyjaśnione w kolejnej sekcji.
Nomenklatura
Gdy związek ma grupę C = O, mówi się, że jest karbonylem. Tak więc, w zależności od charakteru związku karbonylowego, ma on swoje własne zasady nazewnictwa.
Chociaż bez względu na to, co to jest, wszystkie mają wspólną zasadę: C = O ma pierwszeństwo w łańcuchu węglowym przy wymienianiu atomów węgla.
Oznacza to, że jeśli istnieją rozgałęzienia, atomy halogenu, azotowe grupy funkcyjne, wiązania podwójne lub potrójne, to żadne z nich nie może mieć numeru lokalizatora mniejszego niż C = O; dlatego najdłuższy łańcuch zaczyna być wyliczany jak najbliżej grupy karbonylowej.
Z drugiej strony, jeśli w łańcuchu jest kilka C = O, a jeden z nich jest częścią wyższej grupy funkcyjnej, wówczas grupa karbonylowa będzie miała większy lokator i będzie wymieniana jako podstawnik okso..
A co to za hierarchia? Od najwyższej do najniższej:
-Kwasy karboksylowe, RCOOH
-Ester, RCOOR ”
-Amida, RCONHdwa
-Aldehyd, RCOH (lub RCHO)
-Keton, RCOR
Zastępując R i R 'segmentami molekularnymi, powstają niezliczone związki karbonylowe reprezentowane przez powyższe rodziny: kwasy karboksylowe, estry, amidy itp. Każdy z nich ma przypisaną do niego nomenklaturę tradycyjną lub IUPAC..
Reaktywność
Atak nukleofilowy
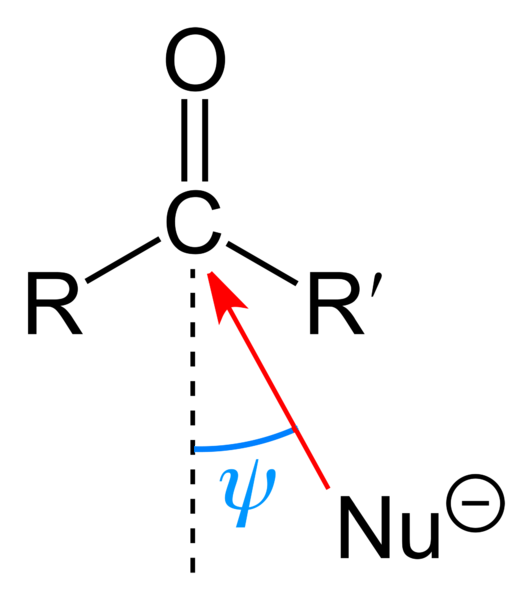
Górny obraz przedstawia atak nukleofilowy, jakiego doznała grupa karbonylowa. Nukleofil, Nu-, może to być anion lub obojętny rodzaj z dostępnymi parami elektronów; jak amoniak, NH3, na przykład. Poszukuje wyłącznie węgla, ponieważ zgodnie ze strukturami rezonansowymi ma dodatni ładunek cząstkowy.
Ładunek dodatni przyciąga Nu-, który będzie dążył do aproksymacji przez „bok” tak, że istnieje najmniejsza przeszkoda przestrzenna z podstawników R i R '. W zależności od tego, jak obszerne są lub wielkości Nu-, atak nastąpi pod różnymi kątami ψ; może być bardzo otwarty lub zamknięty.
Gdy dojdzie do ataku, utworzy się związek pośredni, Nu-CRR'-O-; oznacza to, że tlen pozostaje z parą elektronów, aby umożliwić dodanie Nu- grupa karbonylowa.
Ten ujemnie naładowany tlen może wpływać na inne etapy reakcji; protonowana jako grupa hydroksylowa, OH lub uwalniana jako cząsteczka wody.
Zaangażowane mechanizmy, jak również produkty reakcji uzyskane w wyniku tego ataku, są bardzo zróżnicowane..
Pochodne
Środek nukleofilowy Nu- może to być wiele gatunków. W przypadku każdego z nich podczas reakcji z grupą karbonylową powstają różne pochodne.
Na przykład, gdy wspomnianym środkiem nukleofilowym jest amina, NHdwaR, iminy pochodzą, R.dwaC = NR; jeśli jest to hydroksyloamina, NHdwaOH, daje początek oksymom, RR'C = NOH; jeśli jest to anion cyjankowy, CN-, wytwarzane są cyjanohydryny, RR'C (OH) CN i tak dalej z innymi gatunkami.
Zmniejszenie
Początkowo mówiono, że ta grupa jest utleniona, a więc utleniona. Oznacza to, że biorąc pod uwagę warunki, można go zmniejszyć lub utracić wiązania z atomem tlenu, zastępując go wodorami. Na przykład:
C = O => CHdwa
Ta transformacja wskazuje, że grupa karbonylowa została zredukowana do grupy metylenowej; nastąpił wzrost wodoru w wyniku utraty tlenu. W bardziej odpowiednich terminach chemicznych: związek karbonylowy jest redukowany do alkanu.
Jeśli jest to keton, RCOR ', w obecności hydrazyny, HdwaN-NHdwa, a pożywkę silnie zasadową można zredukować do odpowiedniego alkanu; Ta reakcja jest znana jako redukcja Wolffa-Kishnera:
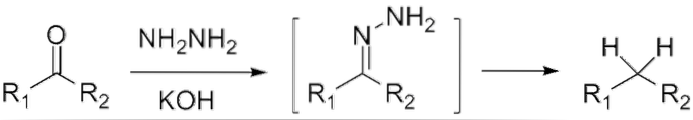
Jeśli, z drugiej strony, mieszanina reakcyjna składa się z amalgamatu cynku i kwasu solnego, reakcja jest znana jako redukcja Clemmensena:
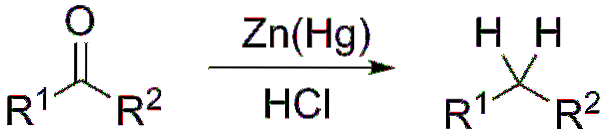
Tworzenie acetali i ketali
Grupa karbonylowa może nie tylko dodawać środki nukleofilowe Nu-, ale w warunkach kwaśnych może również reagować z alkoholami na podstawie podobnych mechanizmów.
Gdy aldehyd lub keton częściowo reaguje z alkoholem, wytwarzane są odpowiednio półacetale lub hemicetale. Jeśli reakcja jest zakończona, produktami są acetale i ketale. Poniższe równania chemiczne podsumowują i wyjaśniają to, o czym właśnie wspomniano:
RCHO + R3OH g RCHOH (OR3) (Hemiacetal) + R.4OH g RCH (OR3) (LUB4) (Acetal)
RCORdwa + R3OH g RCORdwa(OH) (LUB3) (Hemiketal) + R.4OH g RCORdwa(LUB3) (LUB4) (ketal)
Pierwsza reakcja odpowiada tworzeniu półacetali i acetali z aldehydu, a druga hemicetali i ketali z ketonu.
Te równania mogą nie być wystarczająco proste, aby wyjaśnić powstawanie tych związków; Jednak dla pierwszego podejścia do tematu wystarczy zrozumieć, że alkohole są dodawane, a ich łańcuchy boczne R (R3 i R.4) zostają związane z węglem karbonylowym. Dlatego dodaje się OR3 i OR4 do początkowej cząsteczki.
Główną różnicą między acetalem a ketalem jest obecność atomu wodoru związanego z węglem. Zauważ, że keton nie ma tego wodoru.
Rodzaje
Bardzo podobne, jak wyjaśniono w sekcji nomenklatury dla grupy karbonylowej, jej typy są funkcją których są podstawniki A i B lub R i R '. Dlatego istnieją cechy strukturalne, które mają wspólną serię związków karbonylowych poza tylko porządkiem lub rodzajem wiązań..
Przykładowo na początku wspomniano o analogii między tą grupą a tlenkiem węgla C≡O. Jeśli cząsteczka jest pozbawiona atomów wodoru i jeśli istnieją również dwa końcowe C = O, to będzie to tlenek węgla, CnLUBdwa. Dla n równego 3 będziemy mieli:
O = C = C = C = O
To tak, jakby były dwie cząsteczki C≡O połączone i rozdzielone atomem węgla.
Związki karbonylowe mogą pochodzić nie tylko z gazowego CO, ale także z kwasu węglowego, HdwaWSPÓŁ3 lub OH- (C = O) -OH. Tutaj dwa OH oznaczają R i R ', a zastępując jeden z nich lub ich atomy wodoru, otrzymuje się pochodne kwasu węglowego.
Są też pochodne kwasów karboksylowych, RCOOH, otrzymane przez zmianę tożsamości R lub podstawienie H na inny atom lub łańcuch R '(co dałoby początek estru RCOOR').
Jak rozpoznać to w aldehydach i ketonach
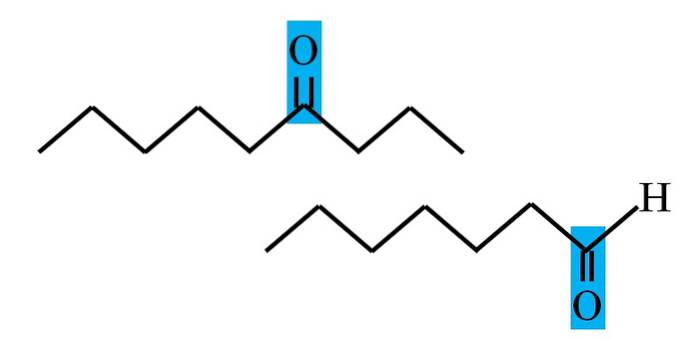
Zarówno aldehydy, jak i ketony mają wspólną obecność grupy karbonylowej. Zawdzięczają temu swoje właściwości chemiczne i fizyczne. Jednak ich środowiska molekularne nie są takie same w obu związkach; w pierwszym przypadku znajduje się w położeniu końcowym, aw drugim w dowolnym miejscu łańcucha.
Na przykład na obrazku powyżej grupa karbonylowa znajduje się wewnątrz niebieskiego pudełka. W ketonach obok tego pudełka musi znajdować się inny segment węgla lub łańcucha (u góry); podczas gdy w aldehydach może być tylko jeden atom wodoru (na dole).
Jeśli C = O znajduje się na jednym końcu łańcucha, będzie to aldehyd; to najbardziej bezpośredni sposób na odróżnienie go od ketonu.
ID
Ale skąd możesz wiedzieć eksperymentalnie, czy nieznany związek jest aldehydem czy ketonem? Istnieje wiele metod, od spektroskopowych (absorpcja promieniowania podczerwonego, IR) po jakościowe badania organiczne.
Jeśli chodzi o testy jakościowe, opierają się one na reakcjach, które w przypadku pozytywnego wyniku analityk zaobserwuje reakcję fizyczną; zmiana koloru, wydzielanie ciepła, tworzenie się pęcherzyków itp..
Na przykład, dodając kwasowy roztwór KdwaCrdwaLUB7 aldehyd zmieni się w kwas karboksylowy, co spowoduje zmianę koloru roztworu z pomarańczowego na zielony (wynik pozytywny). Tymczasem ketony nie reagują, dlatego analityk nie obserwuje żadnej zmiany koloru (test ujemny).
Inny test polega na użyciu odczynnika Tollensa, [Ag (NH3)dwa]+, aldehyd do redukcji kationów Ag+ do metalicznego srebra. Rezultat: powstanie srebrnego lustra na dnie probówki, w której została umieszczona próbka..
Główne przykłady
Na koniec zostanie wymieniona seria przykładów związków karbonylowych:
-CH3COOH, kwas octowy
-HCOOH, kwas mrówkowy
-CH3Samochód3, propanon
-CH3SamochóddwaCH3, 2-butanon
-do6H.5Samochód3, acetofenon
-CH3CHO, etanal
-CH3CHdwaCHdwaCHdwaCHO, pentanal
-do6H.5CHO, benzaldehyd
-CH3CONHdwa, acetamid
-CH3CHdwaCHdwaCOOCH3, octan propylu
Gdyby przytoczyć przykłady związków, które po prostu posiadają tę grupę, lista byłaby prawie nieskończona.
Bibliografia
- Morrison, R. T. and Boyd, R, N. (1987). Chemia organiczna. Wydanie 5. Od redakcji Addison-Wesley Interamericana.
- Carey F. (2008). Chemia organiczna. (Wydanie szóste). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chemia organiczna. Aminy. (Wydanie 10.). Wiley plus.
- Reid Danielle. (2019). Grupa karbonylowa: Właściwości i przegląd. Nauka. Odzyskany z: study.com
- Sharleen Agvateesiri. (05 czerwca 2019). Grupa karbonylowa. Chemia LibreTexts. Źródło: chem.libretexts.org
- Wiki Kids Ltd. (2018). Związki karbonylowe. Odzyskane z: Simply.science
- Toppr. (s.f.). Nazewnictwo i struktura grupy karbonylowej. Odzyskany z: toppr.com
- Clark J. (2015). Utlenianie aldehydów i ketonów. Źródło: chemguide.co.uk


Jeszcze bez komentarzy