
Właściwości halogenków alkilowych, przygotowanie, przykłady

Plik halogenki alkilowe są związkami organicznymi, w których atom węgla z hybrydyzacją sp3 jest kowalencyjnie połączony z halogenem (F, Cl, Br, I). Z innej perspektywy wygodnie jest uprościć, założyć, że są to haloalkany; są to alkany, w których część atomów H została zastąpiona atomami halogenu.
Ponadto, jak wskazuje jego nazwa, atomy halogenu muszą być połączone z grupami alkilowymi, R, aby można je było uznać za ten typ halogenku; chociaż strukturalnie mogą być podstawione lub rozgałęzione i mieć pierścienie aromatyczne i nadal pozostają halogenkiem alkilu.
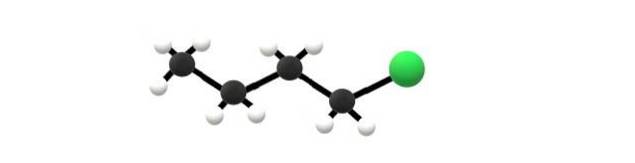
Powyżej znajduje się cząsteczka 1-chlorobutanu, która odpowiada jednemu z najprostszych halogenków alkilu. Można zauważyć, że wszystkie jego węgle mają pojedyncze wiązania, a także mają hybrydyzację sp3. Dlatego zielona kula, odpowiadająca atomowi Cl, jest połączona ze szkieletem pochodzącym z alkanobutanu.
Jeszcze prostsze przykłady niż 1-chlorobutan pochodzą z metanu: najmniejszego węglowodoru ze wszystkich.
Z jego cząsteczki CH4 Atomy H można zastąpić, powiedzmy, jodem. Jeśli podstawiony zostanie H, otrzymamy CH3I (jodometan lub jodek metylu). Podstawiając dwa H, otrzymamy CHdwajadwa (dijodometan lub jodek metylenu). Na koniec I zamienia wszystkie H, dając CHI3 (jodoform) i CI4 (czterojodek węgla).
Halogenki alkilowe charakteryzują się dużą reaktywnością i mając najwięcej elektroujemnych atomów w układzie okresowym, można przypuszczać, że poprzez nieskończone mechanizmy wywierają wpływ na matryce biologiczne.
Indeks artykułów
- 1 Właściwości halogenków alkilu
- 1.1 Temperatury wrzenia i topnienia
- 1.2 Biegunowość
- 1.3 Siła rozpuszczalnika
- 2 Nazewnictwo
- 2.1 Przykład
- 3 Otrzymywanie
- 3.1 Halogenacja światłem lub promieniowaniem ultrafioletowym
- 3.2 Dodawanie węglowodorów lub halogenów do alkenów
- 4 reakcje
- 4.1 Substytucja nukleofilowa
- 4.2 Utylizacja
- 4.3 Synteza odczynników Grignarda
- 5 przykładów
- 6 zastosowań
- 6.1 Rozpuszczalnik
- 6.2 Synteza organiczna
- 6.3 Przemysł farmaceutyczny
- 6.4 Czynniki chłodnicze
- 7 Referencje
Właściwości halogenków alkilowych
Właściwości tej rodziny związków zależą od ich struktury molekularnej. Jednak w porównaniu z tymi z jego pochodnych alkanów można zaobserwować znaczące różnice spowodowane prostym faktem posiadania wiązań C-X (X = atom halogenu).
Oznacza to, że wiązania C-X są odpowiedzialne za wszelkie różnice lub podobieństwa między jednym lub większą liczbą halogenków alkilu..
Po pierwsze, wiązania C-H są prawie niepolarne, biorąc pod uwagę małą różnicę elektroujemności między C i H; z drugiej strony wiązania C-X prezentują trwały moment dipolowy, ze względu na fakt, że halogeny są bardziej elektroujemne niż węgiel (zwłaszcza fluor).
Z drugiej strony, niektóre halogeny są lekkie (F i Cl), podczas gdy inne są ciężkie (Br i I). Ich masy atomowe kształtują również różnice w wiązaniach C-X; i z kolei bezpośrednio na właściwościach halogenku.
Dlatego dodanie halogenów do węglowodoru jest równoznaczne ze zwiększeniem jego polarności i masy cząsteczkowej; oznacza uczynienie go mniej lotnym (do pewnego punktu), mniej łatwopalnym i podwyższeniem jego temperatury wrzenia lub topnienia.
Temperatury wrzenia i topnienia
Mając powyższe na uwadze, rozmiary, a zatem i waga różnych halogenów są pokazane w kolejności rosnącej:
fa < Cl < Br < I
Zatem można oczekiwać, że halogenki alkilowe zawierające atomy F będą lżejsze niż te zawierające atomy Br lub I..
Na przykład rozważa się niektóre halogenki pochodzące z metanu:
CH3fa < CH3Cl < CH3Br < CH3ja
CHdwafadwa < CHdwaCldwa < CHdwaBrdwa < CHdwajadwa
I tak dalej w przypadku innych produktów pochodnych o wyższym stopniu chlorowcowania. Zauważ, że kolejność jest zachowana: halogenki fluoru są lżejsze niż halogenki jodu. Nie tylko to, ale także ich temperatury wrzenia i topnienia również są zgodne z tą kolejnością; RF wrze w niższych temperaturach niż RI (R = CH3, w tym przypadku).
Podobnie wszystkie te ciecze są bezbarwne, ponieważ elektrony nie mogą wchłonąć ani uwolnić fotonów w swoich wiązaniach C-X, aby przejść przez inne poziomy energii. Jednak gdy stają się cięższe, mogą krystalizować i wyświetlać kolory (podobnie jak jodoform, CHI3).
Biegunowość
Wiązania C-X różnią się polaryzacją, ale w odwrotnej kolejności jak powyżej:
C-F> C-Cl> C-Br> C-I
Dlatego wiązania C-F są bardziej polarne niż wiązania C-I. Będąc bardziej polarnymi, halogenki RF mają tendencję do interakcji poprzez siły dipol-dipol. Tymczasem w halogenkach RBr lub RI ich momenty dipolowe są słabsze, a oddziaływanie rządzone przez siły dyspersji londyńskiej zyskuje większą siłę..
Siła rozpuszczalnika
Ponieważ halogenki alkilu są bardziej polarne niż alkany, z których pochodzą, zwiększają ich zdolność do rozpuszczania większej liczby związków organicznych. Z tego powodu są one lepszymi rozpuszczalnikami; nie oznacza to jednak, że mogą one wypierać alkany we wszystkich zastosowaniach.
Istnieją kryteria techniczne, ekonomiczne, ekologiczne i wydajnościowe, aby preferować rozpuszczalnik chlorowcowany nad alkanem.
Nomenklatura
Istnieją dwa sposoby na nazwanie halogenku alkilu: jego nazwą zwyczajową lub nazwą systematyczną (IUPAC). Nazwy zwyczajowe są zwykle wygodniejsze w użyciu, gdy RX jest proste:
CHCl3
Chloroform: nazwa zwyczajowa
Trichlorek metylu lub trichlorometan: nazwa IUPAC.
Ale systematyczne nazwy są preferowane (i jedyna opcja), gdy masz rozgałęzione struktury. Jak na ironię, popularne nazwy są ponownie przydatne, gdy struktury są zbyt skomplikowane (jak te, które zostaną przedstawione w ostatniej sekcji).
Zasady nazewnictwa związku według systemu IUPAC są takie same jak dla alkoholi: identyfikowany jest łańcuch główny, który jest najdłuższy lub najbardziej rozgałęziony. Następnie atomy węgla są wymienione, zaczynając od końca najbliżej podstawników lub rozgałęzień, nazwanych w kolejności alfabetycznej.
Przykład
Aby to zilustrować, mamy następujący przykład:
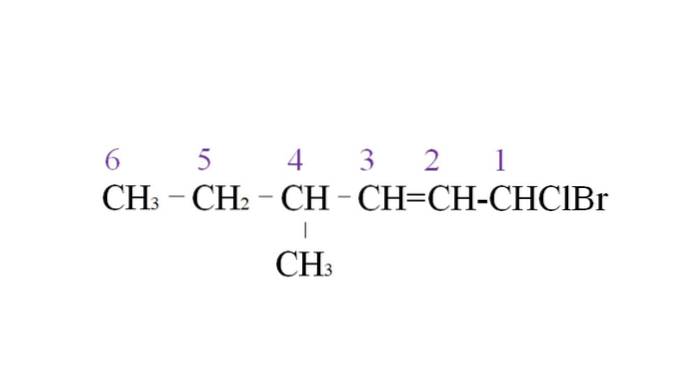
Pierwsza gałąź to grupa metylowa na C-4; ale ponieważ istnieje podwójne wiązanie, zyskuje wyższy priorytet w stosunku do określonej reguły. Z tego powodu najdłuższy łańcuch zaczyna się od prawej strony, na czele z atomem węgla połączonym z dwoma halogenami: Cl i Br.
Przy wyliczeniu podstawniki są nazwane w kolejności alfabetycznej:
1-bromo-1-chloro-4-metylo-2-heksen.
Otrzymywanie
Aby otrzymać halogenki alkilowe, cząsteczki muszą zostać poddane procesowi halogenowania; to znaczy, włączają atomy halogenu do swoich struktur, zwłaszcza atom z węglem sp3.
Istnieją dwie metody ich otrzymywania lub syntezy: za pomocą promieniowania ultrafioletowego w mechanizmie wolnorodnikowym lub przez dodanie węglowodorów lub halogenów..
Halogenacja światłem lub promieniowaniem ultrafioletowym
Pierwsza, najmniej odpowiednia i o najgorszych parametrach, polega na naświetlaniu alkanów promieniowaniem ultrafioletowym (hv) w obecności halogenu. Na przykład równania dotyczące chlorowania metanu są pokazane:
CH4 + Cldwa => CH3Cl + HCl (w świetle UV)
CH3Cl + Cldwa => CHdwaCldwa + HCl
CHdwaCldwa + Cldwa => CHCl3 + HCl
CHCl3 + Cldwa => CCl4 + HCl
Cztery związki (CH3Cl, CHdwaCldwa, CHCl3 i CCl4), a więc otrzymujesz mieszaninę, którą można poddać destylacji frakcyjnej. Jednak ta metoda jest niepraktyczna i preferowane jest uciekanie się do syntez organicznych..
Innym przykładem jest bromowanie n-heksanu:
CH3CHdwaCHdwaCHdwaCHdwaCH3 + Brdwa => CH3(Br) CHCHdwaCHdwaCHdwaCH3 + HBr
Ponownie, w tej reakcji światło lub promieniowanie ultrafioletowe jest wykorzystywane do promowania tworzenia się wolnych rodników. Brom, ponieważ jest ciemnoczerwoną cieczą, zmienia kolor podczas reakcji, obserwując w ten sposób zmianę koloru z czerwonego na bezbarwny, gdy tworzy się 2-bromoheksan..
Dodatek węglowodorów lub halogenów do alkenów
Druga metoda otrzymywania halogenków alkilowych polega na obróbce alkoholi (ROH) lub alkenów (RdwaC = CRdwa) z węglowodanami. Hydracydy mają ogólny wzór HX (HF, HCl, HBr i HI). Przykład zostanie pokazany przy użyciu etanolu dla każdego z nich:
CH3CHdwaOH + HF => CH3CHdwaF + HdwaLUB
CH3CHdwaOH + HCl => CH3CHdwaCl + HdwaLUB
CH3CHdwaOH + HBr => CH3CHdwaBr + HdwaLUB
CH3CHdwaOH + HI => CH3CHdwaI + HdwaLUB
Podobnie, alkeny mogą dodawać cząsteczki HX do swoich podwójnych wiązań, tworząc drugorzędowe halogenki alkilu..
CHdwa= CH-CH3 + HBr => BrCHdwa-CHdwa-CH3 + CH3-CHBr-CH3
Produkt BrCHdwa-CHdwa-CH3 oznacza 1-bromopropan i CH3-CHBr-CH3 2-bromopropan. Drugi jest produktem większościowym, ponieważ jest najbardziej stabilny, podczas gdy pierwszy jest wytwarzany w mniejszym stopniu, ponieważ jest bardziej niestabilny. To dlatego, że CH3CHBrCH3 jest drugorzędowym halogenkiem alkilu.
Bardzo podobnie dzieje się, gdy to, co jest dodawane do alkenu, jest cząsteczką Xdwa:
CHdwa= CH-CH3 + Brdwa => BrCHdwa-CHBr-CH3
Jednakże, otrzymuje się halogenek alkilu z dwoma atomami bromu związanymi z sąsiednimi atomami węgla; wicynalny halogenek alkilu. Z drugiej strony, gdybyś miał dwa bromy przyłączone do tego samego węgla, miałbyś geminalny halogenek alkilu, taki jak poniżej:
BrdwaCH-CHdwa-CH3
Reakcje
Substytucja nukleofilowa
Reaktywności halogenków alkilu są oparte na kruchości lub sile wiązania C-X. Im cięższy halogen, tym słabsze wiązanie, a tym samym łatwiej będzie się zrywać. W reakcji chemicznej pękają wiązania i powstają nowe; Wiązania C-X są zrywane, tworząc wiązanie C-G (G = nowa grupa).
Mówiąc bardziej stosownie, X działa jako grupa opuszczająca, a G jako grupa wchodząca w reakcji substytucja nukleofilowa. Dlaczego zachodzi taka reakcja? Ponieważ X, będąc bardziej elektroujemnym niż węgiel, „kradnie” gęstość elektronów, pozostawiając deficyt elektronów, który przekłada się na dodatni ładunek częściowy:
doδ+-Xδ-
Jeśli gatunek negatywny (: G.-) lub neutralny z dostępną parą elektronów (: G), zdolny do tworzenia bardziej stabilnego wiązania C-G, X zostanie zastąpiony przez G. Powyższe można przedstawić za pomocą następującego równania chemicznego:
RX +: G.- => RG + X-
Im słabsze wiązanie C-X lub R-X, tym większa jego reaktywność lub tendencja do zastąpienia przez środek nukleofilowy (lub nukleofil) G; to znaczy miłośnicy jąder atomowych lub ładunków dodatnich.
Przykłady
Poniżej przedstawiono szereg ogólnych równań dla podstawień nukleofilowych, którym mogą podlegać halogenki alkilowe:
RX + OH- => ROH + X- (Alkohole)
+ LUB'- => ROR' (Etery, synteza Williamsona)
+ ja- => RI (jodki alkilu)
+ CN- => RCN (nitryle)
+ R'COO- => RCOOR '(Estry)
+ NH3 => RNHdwa (Aminy)
+ P (C.6H.5)3 => RP (C6H.5)3+ X- (Sole fosfoniowe)
+ SH- => RSH (Tiole)
Na podstawie tych przykładów można już podejrzewać, jak cenne są halogenki alkilu w syntezach organicznych. Jednym z wielu podstawień, które pozostały do przytoczenia, jest reakcja Friedela Craftsa, używana do „dzierżawy” pierścieni aromatycznych:
RX + ArH + AlCl3 => ArR
W tej reakcji H pierścienia aromatycznego jest zastępowane przez grupę R z RX.
Eliminacja
Halogenki alkilowe mogą uwalniać cząsteczki HX w wyniku reakcji eliminacji; w szczególności dehydrohalogenacja:
RdwaCH-CXRdwa + O- => R.dwaC = CRdwa + HX
Mówi się, że dehydrohalogenacja zachodzi, ponieważ zarówno H, jak i X są tracone w tej samej cząsteczce HX.
Synteza odczynników Grignarda
Halogenki alkilu mogą reagować z niektórymi metalami, tworząc odczynnik Grignarda, używany do dodawania grup R do innych cząsteczek. Ogólne równanie jego syntezy jest następujące:
RX + Mg => RMgX
Przykłady
W różnych rozdziałach wymieniono już różne przykłady halogenków alkilowych. Niektóre inne, proste, to:
-Chlorek etylu, CH3CHdwaCl
-Fluorek izopropylu (CH3)dwaCHdwafa
-2-metylo-3-chloropentan, CH3-CH (CH3) -CHCl-CHdwaCH3
-jodek sec-butylu, CH3CHdwaCHdwaI-CH3
-3-bromo-6-jodoheptan, CH3-CHdwa-CHBr-CHdwa-CHdwa-CHdwaja
-3,4-dibromo-1-penten, CH3-CHBr-CHBr-CH = CHdwa
Aplikacje
Rozpuszczalnik
W poprzednich rozdziałach wspomniano o pojemności rozpuszczalników halogenków alkilowych. Przemysł wykorzystał tę właściwość, aby używać ich jako środków czyszczących, zarówno do materiałów tekstylnych, elementów elektronicznych, jak i do usuwania plam z lakieru..
Podobnie są używane jako rozpuszczalniki do farb lub próbki organiczne lub tłuste do niezliczonych rodzajów testów analitycznych..
Synteza organiczna
Halogenki alkilowe są bardzo przydatne do „alkilowania” pierścieni aromatycznych, będąc jednocześnie źródłem wyjściowym do syntezy praktycznie wszystkich innych rodzin związków organicznych. Syntetycznie RX jest uważane za źródło grup lub łańcuchów R, które mogą być pożądane do włączenia do wysoce aromatycznych związków..
Przemysł farmaceutyczny
Na początku wspomniano, że atomy halogenu oddziałują z biologicznymi matrycami, dzięki czemu w naszych organizmach nie mogą one pozostać niezauważone bez wytworzenia zmiany, pozytywnej lub negatywnej. Jeśli lek ma pozytywny wpływ na organizm, zawierający atom halogenu, działanie to może się nasilić lub nie.
Więc jeśli X jest bezpośrednio związany z węglem o hybrydyzacji sp3, będzie miał halogenek alkilu, a nie pochodną chlorowcowaną. Niektóre z takich halogenków są pokazane poniżej na następującej serii zdjęć:
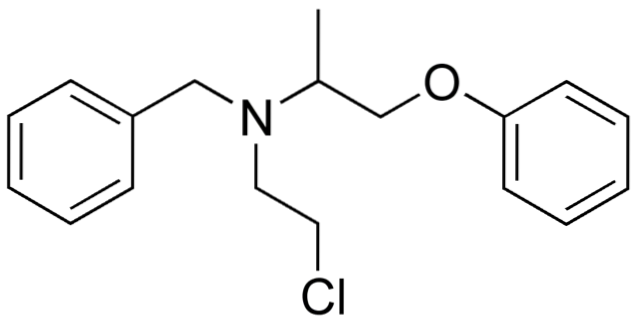
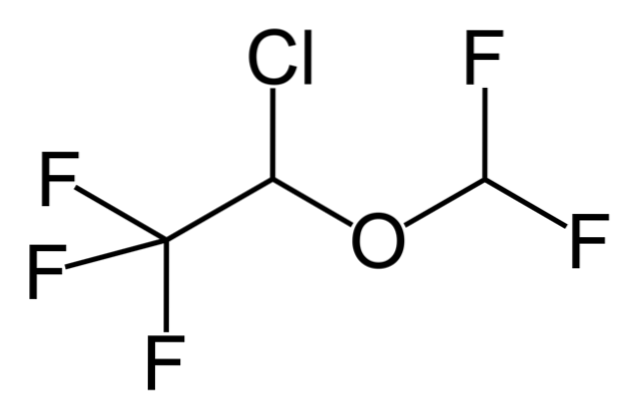

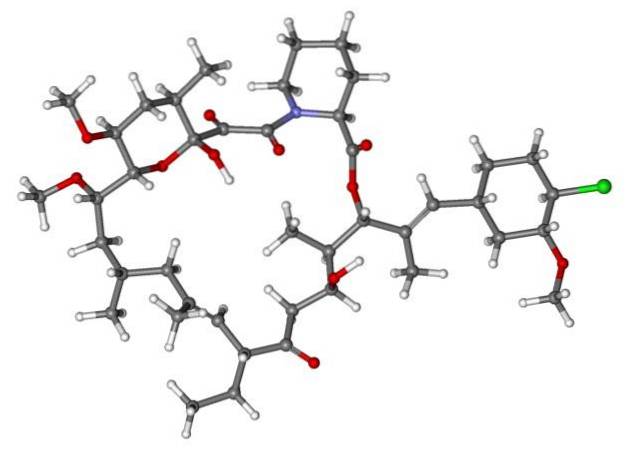

Zauważ, że w tych pięciu lekach jest co najmniej jedno wiązanie typu CHdwa-X lub CH-X; to znaczy, halogen jest przyłączony do węgla sp3.
Czynniki chłodnicze
Słynny czynnik chłodniczy Freon-12 (CHCIFdwa), podobnie jak inne fluoroalkany lub wodorofluorowęglowodory, zastąpiły w tej funkcji gazy amoniakalne i chlorofluorowęglowodory (CFC), ponieważ chociaż są substancjami nielotnymi lub toksycznymi, niszczą warstwę ozonową; podczas gdy freon-12, będąc bardziej reaktywnym, ulega zniszczeniu przed osiągnięciem takich wysokości.
Bibliografia
- Carey F. (2008). Chemia organiczna. (Wydanie szóste). Mc Graw Hill.
- Clark Jim. (14 lipca 2016). Zastosowania halogenków alkilowych. Chemia LibreTexts. Źródło: chem.libretexts.org
- Gál, B., Bucher, C. i Burns, N. Z. (2016). Chiralne halogenki alkilowe: niedocenione motywy w medycynie. Marine Drugs, 14 (11), 206. doi: 10.3390 / md14110206
- Halogenki alkilowe. Odzyskany z: chemed.chem.purdue.edu
- Patkar Prachi. (16 lipca 2017). Wszystko o halogenkach alkilu: właściwości, zastosowania i wiele więcej. Nauka uderzyła. Odzyskany z: sciencestruck.com
- R. Ship. (2016). Halogenki alkilowe. Odzyskane z: hyperphysics.phy-astr.gsu.edu
- Przewodnik do rozdziału 9 - Halogenki alkilowe I. Źródło: cactus.dixie.edu
- Q.A. Eduardo Vega Barrios. (s.f.). Halogenki alkilowe: właściwości, zastosowania i zastosowania. [PDF. Odzyskany z: cvonline.uaeh.edu.mx


Jeszcze bez komentarzy