
Charakterystyka hemolizyny, rodzaje, mechanizmy działania

Plik hemolizyna Jest to małe białko, które powoduje powstawanie porów w błonie komórkowej erytrocytów i niektórych innych komórkach krwi ssaków. Jest generalnie syntetyzowany i wydalany przez bakterie chorobotwórcze.
Białko to jest jedną z najpowszechniejszych toksyn mikrobiologicznych i najlepiej zbadaną. Czasami może powodować anemię hemolityczną, ponieważ liczba kanałów, przez które wychodzi wnętrze komórki, może nawet powodować lizę komórek.
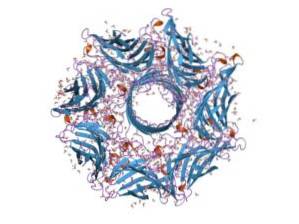
Ogólnie hemolizyna jest typową toksyną z gatunku Paciorkowiec przewodu pokarmowego. Jego funkcja umożliwia bakteriom przełamanie bariery nabłonkowej przewodu pokarmowego i tym samym przemieszczanie się przez krwioobieg w celu kolonizacji innych tkanek..
Najbardziej rozpowszechnioną formą hemolizyny w przyrodzie jest jej α-hemolizyna. Białko to jest jednym z najważniejszych czynników wirulencji większości szczepów Escherichia coli i niektóre clostridia.
Większość infekcji dróg moczowych jest wywoływana przez szczepy Escherichia coli wytwarzanie α-hemolizyny o właściwościach hemolitycznych.
Wytwarzanie hemolizyny i bakteriocyny w szczepach bakteryjnych jest związane z mechanizmem współzawodnictwa z innymi gatunkami, a produkcja obu toksyn wydaje się zależeć od tych samych determinantów genetycznych w genomie bakterii..
Indeks artykułów
- 1 Funkcje
- 2 rodzaje
- 2,1 α-hemolizyna
- 2,2 β-hemolizyna
- 2,3 γ-hemolizyna
- 3 Mechanizmy działania
- 3.1 Wiązanie membranowe
- 3.2 Wprowadzenie toksyny do błony
- 3.3 oligomeryzacja
- 4 Odnośniki
Charakterystyka
Hemolizyna składa się z siedmiu podjednostek, a gen, który ją koduje, ma siedem promotorów. Te siedem podjednostek wstawia się do błony plazmatycznej komórek docelowych i łącząc się, tworzy kanał jonowy, przez który uciekają metabolity z wnętrza komórki..
Hemolizyna jest zewnątrzkomórkową cytotoksyną zależną od wapnia (Ca + 2), która działa na błonę plazmatyczną komórek krwi. Pory, które tworzy w błonie, są również hydrofilne i powodują przedostawanie się wody do wnętrza komórki, co może prowadzić do lizy..
Hemolizyny są typowymi produktami białkowymi bakterii Gram-ujemnych i wszystkie mają dwie cechy:
1- Obecność bardzo małego peptydu (nonapeptydu) składającego się z powtórzeń aminokwasów glicyny i kwasu asparaginowego. Nonapeptydy hemolizyny znajdują się w pobliżu C-końcowej części pierwotnej struktury białka.
2- Wszystkie hemolizyny są wydzielane przez bakterie do środowiska zewnątrzkomórkowego przez transporter typu ABC (kaseta wiążąca ATP).
Wytwarzanie hemolizyny jest zwykle wykrywane w szczepach bakteryjnych poprzez wzrost na podłożu agarowym z krwią. W teście obserwuje się hemolityczne halo, produkt rozpadu czerwonych krwinek w pobliżu kolonii bakterii.
Rodzaje
Istnieje kilka różnych typów hemolizyn, które są klasyfikowane grecką literą na początku nazwy. Najbardziej zbadane i powszechne są hemolizyny α, β i γ, wszystkie wytwarzane przez szczep Staphylococcus aureus.
Rodzaje hemolizyny są klasyfikowane według zakresu komórek, które atakują, oraz zgodnie z ich pierwotną strukturą białka..
α-hemolizyna
To białko jest typowe dla szczepów Staphylococcus aureus Y Escherichia coli; atakuje neutrofile, czerwone krwinki, limfocyty, makrofagi, dorosłe i embrionalne fibroblasty. Oddziałuje z polarnymi głowami lipidów błony plazmatycznej tych komórek, aby internalizować hydrofobowy ogon około 5 Ӑ wewnątrz błony.
β-hemolizyna
Wyprodukowano przez Staphylococcus aureus W mniejszym stopniu niż α-hemolizyna, β-hemolizyna atakuje głównie erytrocyty i wnika do błony komórkowej wyłącznie przez bogate w sfingomielinę domeny błony komórkowej.
γ-hemolizyna
Zaobserwowano to również w Staphylococcus aureus. Został sklasyfikowany jednocześnie jako białko hemolityczne i leukotoksyna, ponieważ wpływa na komórki polimorfojądrowe ludzi, monocyty, makrofagi, a rzadko nawet czerwone krwinki..
Ten typ γ-hemolizyny należy do najsłabiej scharakteryzowanych, dlatego znaczna część mechanizmu jej działania jest nieznana i nie została zbadana. in vivo.
Mechanizmy działania
Mechanizm działania, który został stosunkowo jasno wyjaśniony, to mechanizm α-hemolizyny. Jednak ponieważ wszystkie są białkami hemolitycznymi, uważa się, że większość procesów jest wspólna dla wszystkich hemolizyn..
Naukowcy sugerują, że aby bakterie mogły wydzielać hemolizynę do środowiska, muszą znajdować się w mikrośrodowisku ubogim w składniki odżywcze, dlatego byłby to mechanizm, który pobudza komórkę do niszczenia komórek docelowych i uzyskiwania ich składników odżywczych..
Mechanizm opisano w trzech etapach: wiązanie do błony komórkowej, insercja i oligomeryzacja..
Wiązanie membranowe
Stwierdzono, że hemolizyny są zdolne do wiązania się z integrynami neutrofili, aw erytrocytach białka te wiążą się z glikozylowanymi składnikami, takimi jak glikoproteiny, gangliozydy i glikoforyny błony komórkowej..
Niektórzy autorzy sugerują, że obecność receptorów na błonie nie jest niezbędna do wiązania hemolizyn. W każdym razie mechanizm ponownego zjadania białka przez komórki nie jest jeszcze dokładnie poznany..
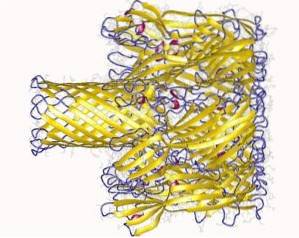
Interakcja z membraną przebiega w dwóch etapach:
- Początkowe wiązanie (odwracalne): kiedy hemolizyna wiąże się z domenami błony wiążącymi wapń. Ten etap zachodzi na powierzchni i jest bardzo podatny na wyładowania elektrostatyczne..
- Nieodwracalne wiązanie: łączy domeny aminokwasowe ze składnikami lipidowymi zewnętrznej warstwy błony plazmatycznej komórek docelowych, w celu utworzenia fizycznych wiązań między hydrofobowymi związkami błony.
Wprowadzenie toksyny do błony
Α-Hemolizyna wstawia pozostałości 177 i 411 do pierwszej monowarstwy lipidowej. W środowisku pozakomórkowym hemolizyna jest związana z jonami wapnia, które indukują w nim uporządkowanie strukturalne i przyczyniają się do jego aktywacji..
To wstawienie utrwala nieodwracalne połączenie z błoną komórkową. Po uporządkowaniu hemolizyna staje się integralnym białkiem, ponieważ eksperymentalnie wykazano, że jedynym sposobem ekstrakcji jej z błony jest użycie detergentów, takich jak Triton X-100..
Oligomeryzacja
Kiedy cała hemolizyna zostanie wprowadzona do błony plazmatycznej komórek docelowych, następuje oligomeryzacja 7 podjednostek, które ją tworzą, co kończy się utworzeniem porów białkowych, bardzo dynamicznych, ale zależnych od składu lipidów błony ..
Zaobserwowano, że procesowi oligomeryzacji sprzyjają mikrodomeny lub tratwy lipidowe błony komórkowej. Regiony te mogą nie sprzyjać wiązaniu białka, ale sprzyjają jego oligomeryzacji po wstawieniu..
Im więcej hemolizyn wiąże się z błoną, tym więcej porów się utworzy. Ponadto hemolizyny mogą się wzajemnie oligomeryzować (sąsiednie) i tworzyć znacznie większe kanały..
Bibliografia
- Bakás, L., Ostolaza, H., Vaz, W. L., & Goñi, F. M. (1996). Odwracalna adsorpcja i nieodwracalne wstawienie alfa-hemolizyny Escherichia coli do dwuwarstw lipidowych. Czasopismo biofizyczne, 71 (4), 1869-1876.
- Dalla Serra, M., Coraiola, M., Viero, G., Comai, M., Potrich, C., Ferreras, M.,… & Prévost, G. (2005). Dwuskładnikowe γ-hemolizyny Staphylococcus aureus, HlgA, HlgB i HlgC, mogą tworzyć mieszane pory zawierające wszystkie składniki. Journal of Chemical Information and Modeling, 45 (6), 1539-1545.
- Gow, J. A. i Robinson, J. (1969). Właściwości oczyszczonej β-hemolizyny gronkowcowej. Journal of bakteriology, 97 (3), 1026-1032.
- Ike, Y., Hashimoto, H., & Clewell, D. B. (1984). Hemolizyna z podgatunku Streptococcus faecalis zymogenes przyczynia się do zjadliwości u myszy. Infection and Immunity, 45 (2), 528-530.
- Remington, J. S., Klein, J. O., Wilson, C. B., Nizet, V., & Maldonado, Y. A. (red.). (1976). Choroby zakaźne płodu i noworodka (tom 4). Filadelfia: Saunders.
- Todd, E. W. (1932). Antygenowa hemolizyna paciorkowców. Journal of Experimental Medicine, 55 (2), 267-280.


Jeszcze bez komentarzy