
Właściwości węglowodorów alifatycznych, nazewnictwo, reakcje, rodzaje
Plik Węglowodory alifatyczne to wszystkie, którym brakuje aromatyczności, nie w sensie węchowym, ale ze względu na stabilność chemiczną. Klasyfikacja węglowodorów w ten sposób jest obecnie zbyt niejednoznaczna i nieprecyzyjna, ponieważ nie rozróżnia różnych rodzajów węglowodorów, które nie są aromatyczne..
Mamy więc węglowodory alifatyczne i węglowodory aromatyczne. Te ostatnie są rozpoznawane przez ich podstawową jednostkę: pierścień benzenowy. Z drugiej strony, inne mogą przyjąć dowolną strukturę molekularną: liniową, rozgałęzioną, cykliczną, nienasyconą, policykliczną; o ile nie mają sprzężonych układów, takich jak benzen.

Termin „alifatyczny” wywodzi się z greckiego słowa „aleiphar”, które oznacza tłuszcz, używanego również w odniesieniu do olejów. Dlatego w XIX wieku klasyfikację tę przypisano węglowodorom otrzymywanym z olejowych ekstraktów; podczas gdy węglowodory aromatyczne były ekstrahowane z żywic drzewnych i pachnące.
Jednak w miarę utrwalania podstaw chemii organicznej odkryto, że istnieje chemiczna właściwość różnicująca węglowodory, nawet ważniejsza niż ich naturalne źródła: aromatyczność (a nie zapach).
W ten sposób węglowodory alifatyczne przestały być tylko tymi, które są pozyskiwane z tłuszczów, a były to wszystkie pozbawione aromatów. W tej rodzinie mamy alkany, alkeny i alkiny, niezależnie od tego, czy są liniowe, czy cykliczne. Dlatego określenie „alifatyczne” jest uważane za nieprecyzyjne; chociaż warto odnieść się do pewnych ogólnych aspektów.
Na przykład, kiedy mówisz alifatyczne „końce” lub „łańcuchy”, masz na myśli obszary molekularne, w których nie ma pierścieni aromatycznych. Spośród wszystkich węglowodorów alifatycznych najprostszym z definicji jest metan, CH4; a benzen jest najprostszym z węglowodorów aromatycznych.
Indeks artykułów
- 1 Właściwości węglowodorów alifatycznych
- 2 Nazewnictwo
- 3 reakcje
- 3.1 Spalanie
- 3.2 Dodatek
- 3.3 Halogenacja
- 3.4 Pękanie
- 4 rodzaje
- 5 zastosowań
- 6 przykładów
- 7 Referencje
Właściwości węglowodorów alifatycznych
Właściwości węglowodorów alifatycznych różnią się w różnym stopniu w zależności od tego, które z nich są brane pod uwagę. Są takie o małej i dużej masie cząsteczkowej, a także liniowe, rozgałęzione, cykliczne lub policykliczne, a nawet te o zadziwiającej strukturze trójwymiarowej; jak z kubańskim, w kształcie sześcianu.
Można jednak wspomnieć o kilku kwestiach ogólnych. Większość węglowodorów alifatycznych to hydrofobowe i niepolarne gazy lub ciecze, przy czym niektóre są bardziej niepolarne niż inne, ponieważ nawet te, w których łańcuchy węglowe zawierają atomy halogenu, tlenu, azotu lub siarki..
Podobnie są związkami łatwopalnymi, ponieważ są podatne na utlenianie w powietrzu przy minimalnym źródle ciepła. Ta cecha staje się bardziej niebezpieczna, jeśli dodamy jej wysoką lotność, ze względu na słabe interakcje dyspersyjne, które utrzymują razem cząsteczki alifatyczne..
Widzimy to na przykład w butanie, gazie, który może skraplać się stosunkowo łatwo, jak propan. Oba są bardzo lotne i łatwopalne, dzięki czemu są aktywnymi składnikami gazu kuchennego lub kieszonkowych zapalniczek..
Oczywiście lotność ta ma tendencję do zmniejszania się wraz ze wzrostem masy cząsteczkowej, a węglowodór wytwarza coraz bardziej lepkie i oleiste ciecze..
Nomenklatura
Nazewnictwo węglowodorów różni się nawet bardziej niż ich właściwości. Jeśli są to alkany, alkeny lub alkiny, przestrzegane są te same zasady określone przez IUPAC: wybierz najdłuższy łańcuch, przypisując najniższe liczby wskaźników do najbardziej podstawionego końca lub do najbardziej reaktywnych heteroatomów lub grup.
W ten sposób wiadomo, na którym atomie węgla znajduje się każdy podstawnik, a nawet nienasycenia (wiązania podwójne lub potrójne). W przypadku węglowodorów cyklicznych, nazwę poprzedzają podstawniki wymienione w kolejności alfabetycznej, po których następuje słowo „cykl”, zliczające liczby atomów węgla, które ją tworzą..
Na przykład rozważ następujące dwa cykloheksany:
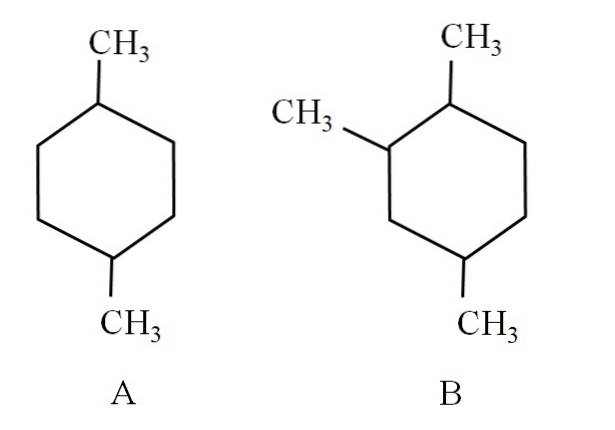
Cykloheksan A nazywany jest 1,4-dimetylocykloheksanem. Gdyby pierścień miał pięć atomów węgla, byłby to 1,4-dimetylocyklopentan. Tymczasem cykloheksan B nazywany jest 1,2,4-trimetylocykloheksanem, a nie 1,4,6-cykloheksanem, ponieważ stara się wykorzystać najniższe wskaźniki.
Teraz nazewnictwo może być bardzo skomplikowane w przypadku węglowodorów o dziwacznych strukturach. Dla nich istnieją bardziej szczegółowe zasady, które należy wyjaśnić osobno i dokładnie; jak w przypadku dienów, terpenów, polienów i związków policyklicznych.
Reakcje
Spalanie
Na szczęście dla tych węglowodorów reakcje są mniej zróżnicowane. O jednym z nich już wspomniano: łatwo się palą, wytwarzając dwutlenek węgla i wodę, a także inne tlenki lub gazy w zależności od obecności heteroatomów (Cl, N, P, O itp.). Jednak COdwa i HdwaCzy też są głównymi produktami spalania.
Dodanie
Jeśli zawierają nienasycenia, mogą ulegać reakcjom addycji; to znaczy, włączają małe cząsteczki do swoich szkieletów jako podstawniki zgodnie z określonym mechanizmem. Wśród tych cząsteczek jest woda, wodór i halogeny (F.dwa, Cldwa, Brdwa i jadwa).
Halogenacja
Z drugiej strony węglowodory alifatyczne pod wpływem promieniowania ultrafioletowego (hv), a ciepło może rozerwać wiązania C-H, aby wymienić je na wiązania C-X (C-F, C-Cl itp.). Jest to reakcja halogenowania, którą obserwuje się w bardzo krótkołańcuchowych alkanach, takich jak metan czy pentan..
Pękanie
Inną reakcją, której mogą ulegać węglowodory alifatyczne, zwłaszcza alkany o długim łańcuchu, jest krakowanie termiczne. Polega na dostarczaniu intensywnego ciepła tak, aby energia cieplna rozrywała wiązania C-C, a tym samym z dużych cząsteczek powstają małe cząsteczki, bardziej cenione na rynku paliwowym.
Cztery powyższe reakcje są głównymi, którym może ulec alifatyczny węglowodór, przy czym spalanie jest najważniejszym ze wszystkich, ponieważ nie dyskryminuje żadnego związku; wszystkie spłoną w obecności tlenu, ale nie wszystkie dodadzą cząsteczki lub rozpadną się na małe cząsteczki.
Rodzaje
Węglowodory alifatyczne to nieskończona ilość związków, które z kolei są klasyfikowane w bardziej szczegółowy sposób, wskazując stopień ich nienasycenia, a także rodzaj posiadanej struktury..
W zależności od tego, jak są nienasycone, mamy alkany (nasycone), alkeny i alkiny (nienasycone).
Alkany charakteryzują się pojedynczymi wiązaniami C-C, podczas gdy w alkenach i alkinach obserwujemy odpowiednio wiązania C = C i C≡C. Bardzo ogólnym sposobem ich wizualizacji jest wyobrażenie sobie szkieletów węglowych alkanów jako zygzakowatych i wygiętych łańcuchów, będących „kwadratami” dla alkenów i „liniami prostymi” dla alkinów..
Wynika to z faktu, że wiązania podwójne i potrójne dają energię i steryczne ograniczenie w swoich obrotach, „utwardzając” ich struktury..
Alkany, alkeny i alkiny mogą być rozgałęzione, cykliczne lub policykliczne. Dlatego za węglowodory alifatyczne zaliczane są m.in.cykloalkany, cykloalkeny, cykloalkiny oraz związki takie jak dekalina (struktura bicyklo), adamantan (podobny do czapki z daszkiem), heptalen, gonan..
Inne rodzaje węglowodorów powstają z alkenów, takich jak dieny (z dwoma podwójnymi wiązaniami), poleny (z wieloma przemiennymi podwójnymi wiązaniami) i terpeny (związki pochodzące z izoprenu, dienu).
Aplikacje
Ponownie, zastosowania tych węglowodorów mogą się różnić w zależności od tego, który z nich jest brany pod uwagę. Jednak w sekcjach dotyczących właściwości i reakcji wyjaśniono, że wszystkie one spalają się nie tylko w celu uwolnienia cząsteczek gazowych, ale także światła i ciepła. Stanowią zatem rezerwuary energii, przydatne jako paliwa lub źródła ciepła..
Dlatego są używane jako składnik benzyny, na gaz ziemny, w palnikach Bunsena i ogólnie do rozpalania pożarów..
Jednym z najbardziej godnych uwagi przykładów jest acetylen HC≡CH, którego spalanie umożliwia wzbudzenie jonów metali w próbce w atomowej spektrometrii absorpcyjnej prowadzonej w badaniach analitycznych. Powstały ogień można również wykorzystać do spawania.
Ciekłe węglowodory alifatyczne, takie jak parafiny, są często używane jako rozpuszczalniki do ekstrakcji tłuszczów. Ponadto jego działanie rozpuszczalnikowe można wykorzystać do usuwania plam, emalii, farb lub po prostu do przygotowania roztworów określonego związku organicznego.
Te o największej masie cząsteczkowej, lepkiej lub stałej, są używane do produkcji żywic, polimerów lub leków.
Jeśli chodzi o termin „alifatyczny”, jest on często używany w odniesieniu do tych regionów w makrocząsteczce, którym brakuje aromatyczności. Na przykład asfalteny są powierzchownie opisywane jako aromatyczne jądro z łańcuchami alifatycznymi.
Przykłady
Początkowo mówiono, że metan jest najprostszym z węglowodorów alifatycznych. Następuje propan, CH3CHdwaCH3, butan, CH3CHdwaCHdwaCH3, pentan, CH3CHdwaCHdwaCHdwaCH3, oktan, nonan, Dean i tak dalej, mając coraz dłuższe alkany.
To samo dotyczy etylenu, CHdwa= CHdwa, propen, CH3CH = CHdwa, buten, CH3CHdwaCH = CH3, i dla pozostałych alkinów. Jeśli występują dwa wiązania podwójne, są to dieny, a jeśli jest ich więcej niż dwa, polieny. Podobnie, w tym samym szkielecie mogą występować wiązania podwójne i potrójne, co zwiększa złożoność strukturalną..
Wśród cykloalkanów możemy wymienić cyklopropan, cyklobutan, cyklopentan, cykloheksan, cykloheptan, cyklooktan, a także cykloheksen i cykloheksynę. Pochodne rozgałęzione są z kolei otrzymywane ze wszystkich tych węglowodorów, a dostępne przykłady mnożą się jeszcze bardziej (np. 1,4-dimetylocykloheksan).
Z najbardziej reprezentatywnych terpenów mamy limonen, mentol, pinen, witaminę A, skwalen itp. Polietylen to polimer nasycony jednostkami -CHdwa-CHdwa-, więc jest to również przykład tych węglowodorów. Inne przykłady zostały już zacytowane w poprzednich rozdziałach.
Bibliografia
- Morrison, R. T. i Boyd, R, N. (1987). Chemia organiczna. Wydanie 5. Od redakcji Addison-Wesley Interamericana.
- Carey F. (2008). Chemia organiczna. (Wydanie szóste). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chemia organiczna. Aminy. (Wydanie 10.). Wiley plus.
- Helmenstine, dr Anne Marie (22 sierpnia 2019). Definicja węglowodorów alifatycznych. Odzyskany z: thinkco.com
- Wikipedia. (2019). Związek alifatyczny. Odzyskane z: en.wikipedia.org
- Chemia LibreTexts. (20 sierpnia 2019). Węglowodory alifatyczne. Źródło: chem.libretexts.org
- Elizabeth Wyman. (2019). Węglowodory alifatyczne: definicja i właściwości. Nauka. Odzyskany z: study.com

Jeszcze bez komentarzy