
Struktury, funkcje, formy heksokinazy

Plik heksokinaza (HK) jest enzymem, który katalizuje pierwszą reakcję szlaku glikolitycznego w praktycznie wszystkich żywych organizmach, zarówno prokariotach, jak i eukariotach. Odpowiada za przeniesienie grupy fosforylowej do glukozy, wytwarzając glukozę-6P, chociaż może również fosforylować heksozy innych cukrów (6 atomów węgla).
Enzym ten jest klasyfikowany w jednej z dwóch rodzin enzymów kinazy glukozowej (enzymów przenoszących grupy fosforylowe do substratów, takich jak glukoza): rodzina heksokinaz (HK), której członkowie są podzieleni na trzy różne grupy znane jako grupa HK, grupa A i grupa B..
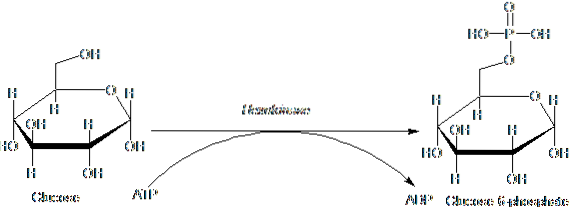
Enzymy należące do rodziny HK charakteryzują się fosforylacją glukozy kosztem ATP jako cząsteczki donorowej grupy fosforylowej, a jej członkowie różnią się między sobą głównie masą cząsteczkową i specyficznością substratową..
Grupa HK obejmuje enzymy organizmów eukariotycznych (ATP: D-heksozo-6-fosfotransferazy), podczas gdy grupa A jest reprezentowana przez enzymy bakterii Gram-ujemnych, cyjanobakterii, amitochondriatów protistów i trypanosomatów, a grupa B zawiera enzymy Gram-dodatnie bakterie i organizmy krenoqueotyczne.
Enzymy z grupy A i B są również znane jako glukokinazy (GlcK), ponieważ są zdolne wyłącznie do fosforylacji glukozy, dlatego enzymy te nazywane są ATP: D-glukozo-6-fosfotransferazy.
Jako enzym glikolityczny, heksokinaza ma duże znaczenie metaboliczne, ponieważ bez niej ta ważna droga nie byłaby możliwa, a komórki w dużym stopniu zależne od spożycia węglowodanów, takie jak komórki mózgowe i mięśniowe wielu ssaków, miałyby ogólnie poważne utrudnienia funkcjonalne i fizjologiczne..
Indeks artykułów
- 1 Struktura
- 2 Funkcje
- 2.1 W roślinach
- 3 kształty
- 4 Odnośniki
Struktura
Jak okaże się później, różne typy enzymów heksokinazy istnieją u ssaków i innych kręgowców (a także w organizmach jednokomórkowych, takich jak drożdże). U ssaków opisano cztery: izoformy I, II, III i IV.
Pierwsze trzy izoenzymy mają masę cząsteczkową 100 kDa, ale izozym IV ma 50 kDa. Te izoenzymy (zwłaszcza I-III) wykazują wysokie podobieństwo sekwencji między nimi w odniesieniu do ich C- i N-końców, jak również z innymi członkami rodziny heksokinaz..
Domena N-końcowa tych enzymów jest uważana za domenę „regulatorową”, podczas gdy aktywność katalityczna jest prowadzona przez domenę C-końcową (ssacze HK II ma miejsca aktywne w obu domenach).
Domena N-końcowa jest połączona z domeną C-końcową przez alfa helisę, każda ma masę cząsteczkową około 50 kDa i ma miejsce wiązania glukozy.
Trzeciorzędowa struktura tych enzymów składa się zasadniczo z β-pofałdowanych arkuszy zmieszanych z alfa helisami, których proporcje różnią się w zależności od enzymu i danego gatunku; miejsce wiązania ATP, innego substratu dla heksokinazy, składa się zwykle z pięciu arkuszy β i dwóch helis alfa.
funkcje
Heksokinaza pełni funkcję transcendentalną w metabolizmie węglowodanów większości żywych istot, ponieważ katalizuje pierwszy etap szlaku glikolitycznego, pośrednicząc w fosforylacji glukozy wewnątrz komórki..
Ten pierwszy etap glikolizy, który polega na przeniesieniu grupy fosforylowej z ATP (donora) do glukozy, w wyniku czego powstaje glukozo-6-fosforan i ADP, jest pierwszym z dwóch etapów inwestycji energii w postaci ATP.
Ponadto reakcja katalizowana przez heksokinazę jest etapem „aktywacji” glukozy w celu jej późniejszej obróbki i stanowi etap „zaangażowania”, ponieważ tak fosforylowana glukoza nie może opuścić komórki za pośrednictwem jej konwencjonalnych transporterów w błonie..
Punktem rozgałęzienia jest produkt reakcji katalizowanej przez heksokinazę, czyli 6-fosforan glukozy, gdyż jest to pierwszy substrat wykorzystywany w szlaku pentozofosforanowym oraz w syntezie glikogenu u wielu zwierząt (i skrobi u roślin).
W roślinach
Funkcja heksokinazy w roślinach nie różni się zbytnio od funkcji zwierząt czy mikroorganizmów, jednak w roślinach wyższych enzym ten działa również jako „czujnik” stężenia cukrów..
Znaczenie tej funkcji w tych organizmach wiąże się z udziałem cukrów jako czynników regulujących ekspresję genów zaangażowanych w różne procesy metaboliczne, takie jak:
- Fotosynteza
- Cykl glioksylanowy
- Oddech
- Degradacja lub synteza skrobi i sacharozy
- Metabolizm azotu
- Obrona przed patogenami
- Regulacja cyklu komórkowego
- Uzdrawiająca odpowiedź
- Pigmentacja
- Starzenie się między innymi.
Ta funkcja heksokinazy jako „czujnika” ilości wewnątrzkomórkowej glukozy została również opisana w przypadku drożdży i ssaków..
Kształty
W naturze istnieją różne formy heksokinaz, a to zależy zasadniczo od rozważanego gatunku.
Na przykład u ludzi i innych kręgowców wykazano istnienie 4 różnych izoform enzymu heksokinazy w przedziale cytozolowym, które oznaczono cyframi rzymskimi I, II, III i IV..
Izoenzymy I, II i III mają masę cząsteczkową 100 kDa, są hamowane przez produkt ich reakcji (glukozo-6-fosforan) i są bardzo związane z glukozą, to znaczy mają bardzo niską stałą Km. Jednak te enzymy mają słabą specyficzność substratową, będąc w stanie fosforylować inne heksozy, takie jak fruktoza i mannoza.
Izoenzym IV, znany również jako glukokinaza (GlcK), ma masę cząsteczkową zaledwie 50 kDa i pomimo tego, że jest słabo spokrewniony (wysokie wartości Km), ma wysoką specyficzność wobec glukozy jako substratu i nie podlega im. Mechanizmy regulacyjne niż pozostałe trzy izoenzymy.
Glukokinaza (izoenzym IV heksokinazy wielu ssaków) znajduje się głównie w wątrobie i pomaga temu organowi w „regulacji” tempa zużycia glukozy w odpowiedzi na zmiany tego substratu we krwi krążącej..
Wydaje się, że trzy geny kodujące heksokinazy I, II i III u zwierząt mają tego samego przodka o masie 50 kDa, który został zduplikowany i połączony w genomie, co wydaje się oczywiste, gdy zaobserwuje się, że aktywność katalityczna form I i III występuje tylko w koniec C-terminal.
Bibliografia
- Aronoff, S. L., Berkowitz, K., Shreiner, B., & Want, L. (2004). Metabolizm i regulacja glukozy: poza insuliną i glukagonem. Spektrum cukrzycy, 17(3), 183-190.
- Harrington, G. N., & Bush, D. R. (2003). Dwufunkcyjna rola heksokinazy w metabolizmie i sygnalizacji glukozy. Komórka roślinna, piętnaście(11), 2493-2496.
- Jang, J. C., León, P., Zhou, L. i Sheen, J. (1997). Heksokinaza jako czujnik cukru w wyższych roślinach. Komórka roślinna, 9(1), 5-19.
- Kawai, S., Mukai, T., Mori, S., Mikami, B., & Murata, K. (2005). Hipoteza: budowa, ewolucja i przodek kinaz glukozowych z rodziny heksokinaz. Journal of Bioscience and Bioengineering, 99(4), 320-330.
- Mathews, K. E. (1998). Van Holde. Biochemia.
- Wilson, J. E. (2003). Izozymy heksokinazy ssaków: budowa, lokalizacja subkomórkowa i funkcja metaboliczna. Journal of Experimental Biology, 206(12), 2049-2057.



Jeszcze bez komentarzy