
Hybrydyzacja chemiczna sp, sp2, sp3
Plik hybrydyzacja chemiczna jest to „mieszanina” orbitali atomowych, której koncepcję przedstawił chemik Linus Pauling w 1931 r. w celu pokrycia niedoskonałości teorii Walencji Bonda (TEV). Jakie niedoskonałości? Są to: geometrie molekularne i równoważne długości wiązań w cząsteczkach, takich jak metan (CH4).
Według TEV, w metanie orbitale atomowe C tworzą cztery wiązania σ z czterema atomami H. Orbitale 2p, z formami kształtów (dolny obraz) C są do siebie prostopadłe, więc H powinien znajdować się w odległości około kilku od innych w Kąt 90º.
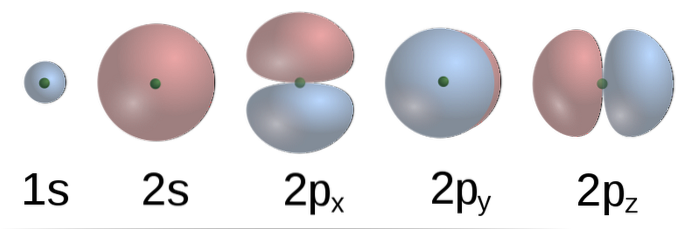
Dodatkowo orbital 2s (kulisty) C wiąże się z orbitalem 1s H pod kątem 135º w stosunku do pozostałych trzech H. Jednak eksperymentalnie stwierdzono, że kąty w CH4 wynosi 109,5 °, a ponadto długości wiązań C-H są równoważne.
Aby to wyjaśnić, należy wziąć pod uwagę połączenie oryginalnych orbitali atomowych, które tworzą cztery zdegenerowane orbitale hybrydowe (o równej energii). Tutaj do gry wkracza hybrydyzacja chemiczna. Jakie są orbitale hybrydowe? Zależy to od orbitali atomowych, które je generują. Wykazują również mieszankę ich elektronicznych właściwości.
Indeks artykułów
- 1 hybrydyzacja sp3
- 1.1 Interpretacja
- 1.2 Odchylenia kątów wiązania
- 2 hybrydyzacja sp2
- Hybrydyzacja 3 sp
- 4 Odnośniki
Hybrydyzacja Sp3
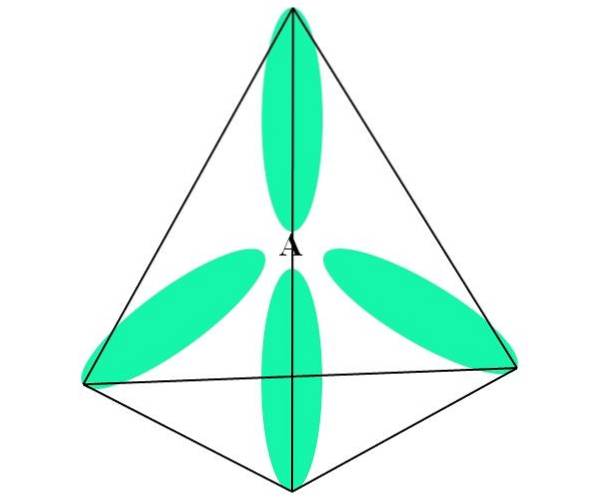
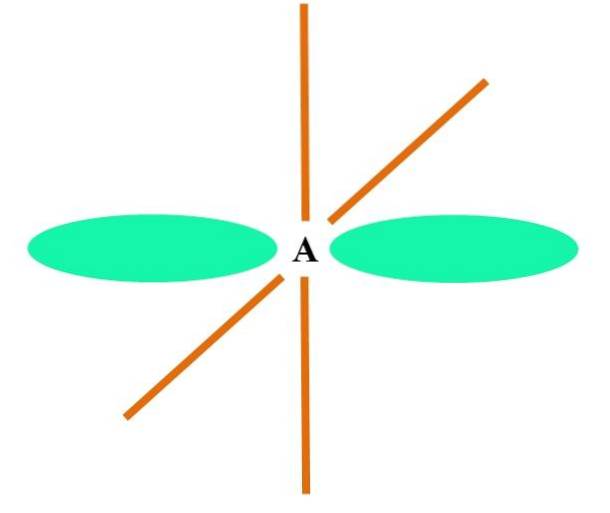
W przypadku CH4, hybrydyzacja C to sp3. Z tego podejścia geometrię molekularną wyjaśnia się za pomocą czterech orbitali sp3 109,5 ° od siebie i skierowana w stronę wierzchołków czworościanu.
Na górnym obrazku widać, jak orbitale sp3 (kolor zielony) tworzą tetraedryczne środowisko elektroniczne wokół atomu (A, co oznacza C jak CH4).
Dlaczego 109,5º a nie inne kąty, aby „narysować” inną geometrię? Powodem jest to, że ten kąt minimalizuje odpychanie elektroniczne czterech atomów, które wiążą się z A..
Zatem cząsteczka CH4 można przedstawić jako czworościan (tetraedryczna geometria molekularna).
Gdyby zamiast H, C utworzyło wiązania z innymi grupami atomów, jaka byłaby ich hybrydyzacja? Dopóki węgiel tworzy cztery wiązania σ (C-A), ich hybrydyzacja będzie sp3.
W konsekwencji można założyć, że w innych związkach organicznych, takich jak CH3OH, CCl4, C (CH3)4, do6H.12 (cykloheksan) itp., węgiel ma hybrydyzację sp3.
Jest to niezbędne do szkicowania struktur organicznych, w których pojedyncze wiązane węgle reprezentują punkty rozbieżności; to znaczy, struktura nie pozostaje w jednej płaszczyźnie.
Interpretacja
Jaka jest najprostsza interpretacja tych orbitali hybrydowych bez uwzględnienia aspektów matematycznych (funkcji falowych)? Orbitale sp3 sugerują, że zostały zapoczątkowane przez cztery orbitale: jeden si trzy p.
Ponieważ zakłada się, że kombinacja tych orbitali atomowych jest idealna, cztery orbitale sp3 w rezultacie są identyczne i zajmują różne orientacje w przestrzeni (na przykład w orbitali px, pY I pz).
Powyższe ma zastosowanie do pozostałych możliwych hybrydyzacji: liczba utworzonych orbitali hybrydowych jest taka sama, jak liczba orbitali atomowych, które są łączone. Na przykład orbitale hybrydowe sp3redwa są utworzone z sześciu orbitali atomowych: jednego s, trzech p i dwóch d.
Odchylenia kąta wiązania
Zgodnie z teorią odpychania par elektronowych powłoki Valencia (RPECV), para wolnych elektronów zajmuje większą objętość niż atom związany. Powoduje to rozchodzenie się ogniw, zmniejszając napięcie elektroniczne i odchylając kąty od 109,5º:
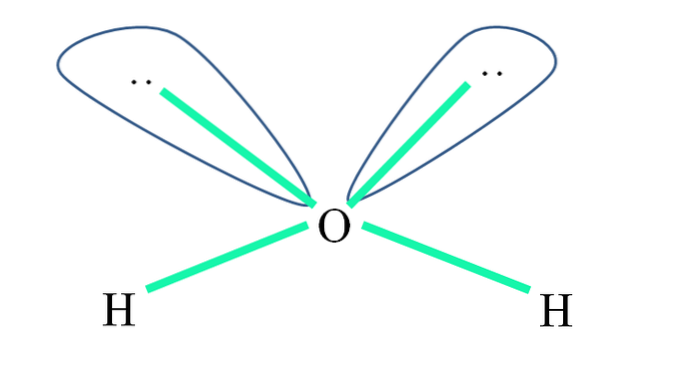
Na przykład w cząsteczce wody atomy H są związane z orbitaliami sp3 (na zielono) i podobnie niewspółdzielone pary elektronów „:” zajmują te orbitale.
Odpychanie tych par elektronów jest zwykle przedstawiane jako „dwie kule z oczami”, które ze względu na swoją objętość odpychają dwa wiązania σ O-H.
Zatem w wodzie kąty wiązania wynoszą w rzeczywistości 105º, zamiast 109,5º oczekiwanych dla geometrii czworościennej..
Jaką wtedy geometrię robi H.dwaLUB? Ma geometrię kątową. Dlaczego? Ponieważ chociaż geometria elektronowa jest tetraedryczna, dwie pary niewspółdzielonych elektronów zniekształcają ją do kątowej geometrii molekularnej.
Hybrydyzacja Spdwa
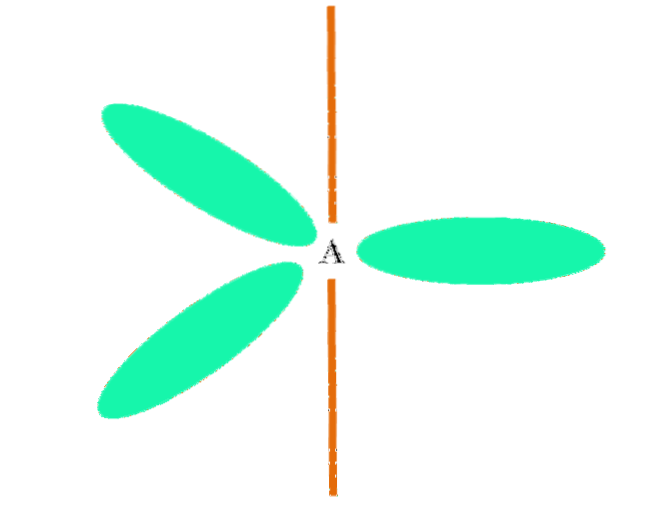
Kiedy atom łączy dwa orbitale p i jeden s, generuje trzy hybrydowe orbitale spdwa; jednak jeden orbital p pozostaje niezmieniony (ponieważ są ich trzy), co jest reprezentowane jako pomarańczowy pasek na górnym obrazku.
Tutaj trzy orbitale spdwa są koloru zielonego, aby podkreślić ich różnicę w stosunku do pomarańczowego paska: „czysty” orbital p.
Atom z hybrydyzacją spdwa można wizualizować jako płaską podłogę trygonalną (trójkąt narysowany za pomocą orbitali spdwa zielony), którego wierzchołki są oddzielone kątami 120º i prostopadłe do pręta.
A jaką rolę odgrywa orbital czysty p? Tworzenie podwójnego wiązania (=). Orbitale spdwa pozwalają na utworzenie trzech wiązań σ, podczas gdy czyste wiązanie orbitalne p jedno π (wiązanie podwójne lub potrójne oznacza jedno lub dwa wiązania π).
Na przykład, aby narysować grupę karbonylową i strukturę cząsteczki formaldehydu (H.dwaC = O), wygląda to następująco:
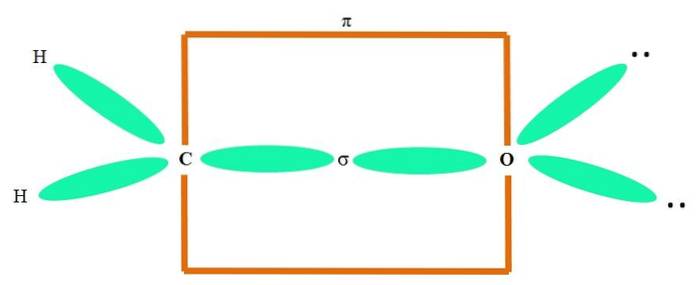
Orbitale spdwa zarówno C, jak i O tworzą wiązanie σ, podczas gdy ich czyste orbitale tworzą wiązanie π (pomarańczowy prostokąt).
Można zobaczyć, jak pozostałe grupy elektronowe (atomy H i niedzielone pary elektronów) znajdują się w innych orbitali sp.dwa, oddzielone o 120º.
Hybrydyzacja Sp
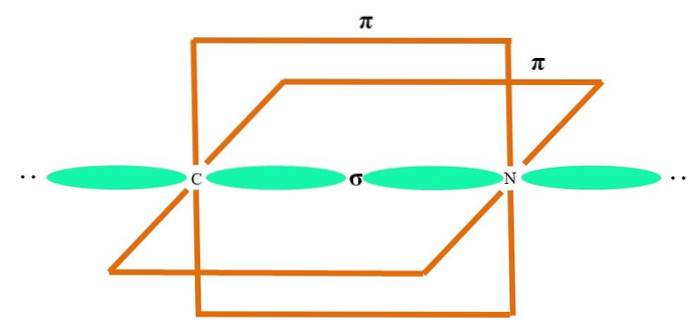
Na górnym obrazie zilustrowany jest atom A z hybrydyzacją sp. Tutaj orbital s i orbital p łączą się, tworząc dwa zdegenerowane orbitale sp. Jednak teraz dwa czyste orbitale p pozostają niezmienione, co pozwala A na utworzenie dwóch wiązań podwójnych lub jednego wiązania potrójnego (≡).
Innymi słowy: jeśli C jest zgodne z powyższym w strukturze (= C = lub C≡C), to jego hybrydyzacja jest sp. W przypadku innych mniej ilustracyjnych atomów - takich jak metale przejściowe - opis geometrii elektronowej i molekularnej jest skomplikowany, ponieważ rozważane są również orbitale d, a nawet orbitale f..
Orbitale hybrydowe są oddalone od siebie o 180 °. Z tego powodu związane atomy są ułożone w liniowej geometrii molekularnej (B-A-B). Wreszcie dolny obraz przedstawia strukturę anionu cyjankowego:
Bibliografia
- Sven. (03 czerwca 2006). Orbitale S-p. [Postać]. Pobrane 24 maja 2018 z: commons.wikimedia.org
- Richard C. Banks. (Maj 2002). Wiązanie i hybrydyzacja. Pobrane 24 maja 2018 z: chemistry.boisestate.edu
- James. (2018). Skrót do hybrydyzacji. Pobrane 24 maja 2018 r. Z: masterorganicchemistry.com
- Dr Ian Hunt. Wydział Chemii, Uniwersytet Calgary. hybrydyzacja sp3. Pobrane 24 maja 2018 z: chem.ucalgary.ca
- Wiązanie chemiczne II: Geometria molekularna i hybrydyzacja orbitali atomowych Rozdział 10. [PDF]. Pobrane 24 maja 2018 z: wou.edu
- Quimitube. (2015). Wiązanie kowalencyjne: wprowadzenie do hybrydyzacji orbitalnej atomowej. Pobrane 24 maja 2018 r. Z: quimitube.com
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Wydanie czwarte, str. 51). Mc Graw Hill.



Jeszcze bez komentarzy