
Struktura wodorotlenku rtęci, właściwości, zastosowania, zagrożenia

Plik wodorotlenek rtęci Jest to związek nieorganiczny, w którym rtęć metalu (Hg) ma stopień utlenienia 2+. Jego wzór chemiczny to Hg (OH)dwa. Jednak gatunek ten nie został jeszcze uzyskany w postaci stałej w normalnych warunkach..
Wodorotlenek rtęci lub wodorotlenek rtęci to krótkotrwały przejściowy związek pośredni w tworzeniu się tlenku rtęci HgO w roztworze zasadowym. Z badań przeprowadzonych w roztworach tlenku rtęci HgO, wywnioskowano, że Hg (OH)dwa to jest słaba podstawa. Inne gatunki, które mu towarzyszą to HgOH+ i Hgdwa+.

Pomimo niemożności wytrącenia w roztworze wodnym, Hg (OH)dwa Został uzyskany w wyniku fotochemicznej reakcji rtęci z wodorem i tlenem w bardzo niskich temperaturach. Otrzymano go również w postaci koprecypitatu wraz z Fe (OH)3, gdzie obecność jonów halogenkowych wpływa na pH, przy którym zachodzi współstrącanie.
Ponieważ nie udało się go łatwo uzyskać w czystości na poziomie laboratoryjnym, nie można było znaleźć żadnego zastosowania dla tego związku ani określić zagrożeń związanych z jego stosowaniem. Można jednak wywnioskować, że stwarza takie same zagrożenia jak inne związki rtęci.
Indeks artykułów
- 1 Struktura cząsteczki
- 2 Konfiguracja elektroniczna
- 3 Nazewnictwo
- 4 Właściwości
- 4.1 Masa cząsteczkowa
- 4.2 Właściwości chemiczne
- 5 Otrzymywanie
- 5.1 Czysty wodorotlenek rtęci
- 5.2 Współstrącanie z wodorotlenkiem żelaza (III)
- 6 zastosowań
- 7 Najnowsze badania
- 8 Ryzyka
- 9 Odniesienia
Struktura cząsteczki
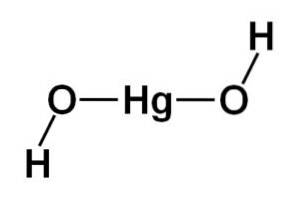
Struktura wodorotlenku rtęci (II) Hg (OH)dwa opiera się na liniowej części centralnej utworzonej przez atom rtęci z dwoma atomami tlenu po bokach.
Atomy wodoru są przymocowane do tej centralnej struktury, każdy obok każdego tlenu, który swobodnie obraca się wokół każdego tlenu. Można to przedstawić w prosty sposób w następujący sposób:
Elektroniczna Konfiguracja
Struktura elektronowa metalicznej rtęci Hg jest następująca:
[Xe] 5re10 6sdwa
gdzie [Xe] jest konfiguracją elektronową ksenonu gazu szlachetnego.
Obserwując tę strukturę elektronową, można wywnioskować, że najbardziej stabilnym stopniem utlenienia rtęci jest ten, w którym utracone są 2 elektrony warstwy 6.s.
W wodorotlenku rtęci Hg (OH)dwa, atom rtęci (Hg) jest na 2+ stopniu utlenienia. Dlatego w Hg (OH)dwa rtęć ma następującą konfigurację elektroniczną:
[Xe] 5re10
Nomenklatura
- Wodorotlenek rtęci (II)
- Wodorotlenek rtęciowy
- Diwodorotlenek rtęci
Nieruchomości
Waga molekularna
236,62 g / mol
Właściwości chemiczne
Zgodnie z konsultowanymi informacjami możliwe jest, że Hg (OH)dwa być przejściowym związkiem w tworzeniu HgO w alkalicznym środowisku wodnym.
Dodatek jonów hydroksylowych (OH-) do wodnego roztworu jonów rtęciowych Hgdwa+ prowadzi do wytrącenia żółtego ciała stałego tlenku rtęci (II) HgO, w tym Hg (OH)dwa jest pracownikiem tymczasowym lub tymczasowym.

W roztworze wodnym Hg (OH)dwa Jest to bardzo krótkotrwały związek pośredni, ponieważ szybko uwalnia cząsteczkę wody i wytrąca się stała HgO.
Chociaż nie było możliwe wytrącenie wodorotlenku rtęci Hg (OH)dwa, tlenek rtęci (II) HgO jest nieco rozpuszczalny w wodzie, tworząc roztwór gatunków zwanych „wodorotlenkami”.
Te gatunki w wodzie zwane „wodorotlenkami” są słabymi zasadami i chociaż czasami zachowują się jak amfoteryczne, na ogół Hg (OH)dwa jest bardziej zasadowy niż kwas.
Kiedy HgO rozpuszcza się w HClO4 badania wskazują na obecność jonu rtęciowego Hgdwa+, jon monohydroksymercuric HgOH+ i wodorotlenek rtęci Hg (OH)dwa.
Równowagi występujące w takich roztworach wodnych są następujące:
Hgdwa+ + H.dwaO ⇔ HgOH+ + H.+
HgOH+ + H.dwaO ⇔ Hg (OH)dwa + H.+
W alkalicznych roztworach NaOH tworzy się rodzaj Hg (OH)3-.
Otrzymywanie
Czysty wodorotlenek rtęci
Wodorotlenek rtęci (II) Hg (OH)dwa Nie można go uzyskać w roztworze wodnym, ponieważ dodając alkalia do roztworu jonów rtęciowych Hgdwa+, wytrąca się żółty tlenek rtęci HgO.
Jednak niektórym badaczom udało się po raz pierwszy uzyskać wodorotlenek rtęci Hg (OH) w 2005 rokudwa za pomocą lampy rtęciowej, zaczynając od pierwiastka rtęć Hg, wodór H.dwa i tlen O.dwa.

Reakcja jest fotochemiczna i została przeprowadzona w obecności stałego neonu, argonu lub deuteru w bardzo niskich temperaturach (około 5 K = 5 stopni Kelvina). Dowód na powstawanie związku uzyskano za pomocą widm absorpcji światła w podczerwieni (IR).
Hg (OH)dwa tak przygotowany jest bardzo stabilny w warunkach doświadczenia. Szacuje się, że reakcja fotochemiczna przebiega przez półprodukt O-Hg-O do stabilnej cząsteczki H-O-Hg-O-H.
Współstrącanie z wodorotlenkiem żelaza (III)
Jeśli rozpuszcza się siarczan rtęci (II) HgSO4 i siarczan żelaza (III) Fedwa(POŁUDNIOWY ZACHÓD4)3 w kwaśnym roztworze wodnym, a pH zaczyna rosnąć po dodaniu roztworu wodorotlenku sodu NaOH, po czasie odstania tworzy się ciało stałe, które jest współstrąceniem Hg (OH)dwa i Fe (OH)3.
Stwierdzono, że powstawanie Hg (OH)dwa jest krytycznym etapem tego współstrącania z Fe (OH)3.
Powstawanie Hg (OH)dwa w osadzie Fe (OH)3-Hg (OH)dwa silnie zależy od obecności jonów, takich jak fluorek, chlorek lub bromek, od ich konkretnego stężenia i od pH roztworu.
W obecności fluoru (F.-), przy pH większym niż 5, współstrącanie Hg (OH)dwa z Fe (OH)3 nie ma na to wpływu. Ale przy pH 4 tworzą się kompleksy między Hgdwa+ i F- zakłóca współstrącanie Hg (OH)dwa.
W przypadku obecności chlorków (Cl-), współstrącanie Hg (OH)dwa występuje przy pH 7 lub wyższym, to znaczy korzystnie w środowisku zasadowym.
Kiedy bromek (Br-), współstrącanie Hg (OH)dwa występuje przy jeszcze wyższym pH, to znaczy powyżej 8,5 lub bardziej zasadowym niż w przypadku chlorków.
Aplikacje
Z przeglądu dostępnych źródeł informacji wynika, że wodorotlenek rtęci (II) Hg (OH)dwa, Będąc związkiem, który nie został jeszcze przygotowany komercyjnie, nie ma znanych zastosowań.
Ostatnie badania
Wykorzystując techniki symulacji obliczeniowej w 2013 r. Zbadano właściwości strukturalne i energetyczne związane z uwodnieniem Hg (OH).dwa w stanie gazowym.
Obliczono i porównano koordynację metal-ligand i energie solwatacji, zmieniając stopień uwodnienia Hg (OH)dwa.
Stwierdzono między innymi, że pozornie teoretyczny stopień utlenienia wynosi 1+ zamiast zakładanego 2+ zwykle przypisywanego dla Hg (OH)dwa.
Ryzyka
Chociaż Hg (OH)dwa jako taki nie został wyodrębniony w wystarczającej ilości i dlatego nie był używany komercyjnie, jego szczególne ryzyko nie zostało określone, ale można wywnioskować, że stwarza takie same zagrożenie jak pozostałe sole rtęci.
Może być toksyczny dla układu nerwowego, układu pokarmowego, skóry, oczu, układu oddechowego i nerek..
Wdychanie, spożycie lub kontakt ze skórą związków rtęci może powodować uszkodzenia, takie jak podrażnienie oczu i skóry, bezsenność, bóle głowy, drżenie, uszkodzenie przewodu pokarmowego, utratę pamięci, niewydolność nerek i inne objawy.
Rtęć została uznana na całym świecie za substancję zanieczyszczającą. Większość związków rtęci, które wchodzą w kontakt ze środowiskiem, jest metylowanych przez bakterie obecne w glebie i osadach, tworząc metylortęć.
Związek ten ulega bioakumulacji w organizmach żywych, przechodząc z gleby do roślin, a stamtąd do zwierząt. W środowisku wodnym transfer jest jeszcze szybszy, przechodząc od bardzo małych do dużych gatunków w krótkim czasie.
Metylortęć ma toksyczny wpływ na istoty żywe, aw szczególności na ludzi, którzy spożywają ją w łańcuchu pokarmowym.
W przypadku spożycia z pożywieniem jest szczególnie szkodliwy dla małych dzieci i płodów u kobiet w ciąży, ponieważ będąc neurotoksyną może powodować uszkodzenie mózgu i układu nerwowego podczas tworzenia się i wzrostu..
Bibliografia
- Cotton, F. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Wang, Xuefeng i Andrews, Lester (2005). Widmo w podczerwieni Hg (OH)dwa w litym neonie i argonie. Inorganic Chemistry, 2005, 44, 108-113. Odzyskany z pubs.acs.org.
- Amaro-Estrada, J.I., i in. (2013). Wodna solwatacja Hg (OH)dwa: Energetyczne i dynamiczne badania teorii funkcjonalnej gęstości Hg (OH)dwa-(H.dwaLUB)n (n = 1-24) Struktury. J. Phys. Chem. A 2013, 117, 9069-9075. Odzyskany z pubs.acs.org.
- Inoue, Yoshikazu i Munemori, Makoto. (1979). Współstrącanie rtęci (II) z wodorotlenkiem żelaza (III). Nauka o środowisku i technologia. Tom 13, numer 4, kwiecień 1979. Odzyskany z pubs.acs.org.
- Chang, L.W., i in. (2010). Toksykologia układu nerwowego i behawioralnego. W kompleksowej toksykologii. Odzyskany z sciencedirect.com.
- Haney, Alan i Lipsey, Richard L. (1973). Akumulacja i wpływ wodorotlenku metylortęci w ziemskim łańcuchu pokarmowym w warunkach laboratoryjnych. Otaczać. Pollut. (5) (1973) str. 305-316. Odzyskany z sciencedirect.com.

Jeszcze bez komentarzy