
Struktura, właściwości podchlorynu potasu (KOCl)
Plik podchloryn potasu Jest to sól potasowa kwasu podchlorawego. Jest również trójskładnikową solą potasu, tlenu i chloru oraz jest związkiem nieorganicznym. Jego wzór chemiczny to KOCl, co oznacza, że kation K znajduje się w jonowym ciele stałym.+ i anion OCl- w stosunku stechiometrycznym 1: 1.
Ich związków homologicznych (LiOCl, NaOCl, Ca (OCl)dwa) jest prawdopodobnie najmniej używany i powszechnie znany w kulturze chemicznej i pragmatycznej. Wszystkie te sole mają wspólny mianownik anionu podchlorynowego (OCl-), co nadaje im główne właściwości jako środka wybielającego.
Historia podchlorynu potasu i jego właściwości fizykochemiczne są podobne do soli podchlorynu sodu. Początkowo został wyprodukowany w 1789 roku przez Claude'a Louisa Bertholleta w Javel w Paryżu. Reakcję autora, która doprowadziła do syntezy tego związku, wyraża następujące równanie chemiczne:
Cldwa + 2KOH => KCl + KClO + HdwaLUB
Zgodnie z równaniem, chlor cząsteczkowy reaguje z wodorotlenkiem potasu (lub potasem żrącym), redukując i utleniając atomy chloru. Można to zweryfikować porównując stopień utlenienia Cl w KCl (-1) ze stopniem utlenienia Cl w KClO (+1).
Indeks artykułów
- 1 Struktura chemiczna
- 2 Nazewnictwo
- 3 Właściwości
- 3.1 Masa molowa
- 3.2 Wygląd
- 3.3 Gęstość
- 3.4 Temperatura topnienia
- 3.5 Temperatura wrzenia
- 3.6 Rozpuszczalność w wodzie
- 3.7 Reaktywność
- 4 Zastosowania
- 5 Referencje
Struktura chemiczna

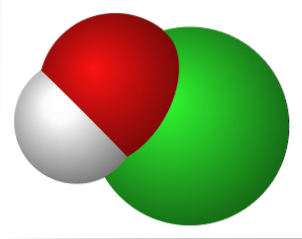
Górny obraz przedstawia oddziaływania elektrostatyczne między kationem K.+ i anion OCl- (z tlenem niosącym ujemny ładunek formalny).
Jony te mają te same proporcje stechiometryczne (1: 1), a ich bezkierunkowe siły tworzą układ krystaliczny, gdzie K+ znajduje się tak blisko atomu O..
Chociaż nie ma badań opisujących układ krystaliczny KOCl (sześcienny, rombowy, jednoskośny itp.), Wystarczy wizualizować go jako dużą kulę K+ przyciągany do jonu OCl o geometrii liniowej-.
Można sądzić, że w przeciwieństwie do NaOCl, KOCl tworzy kryształy o niższej energii sieci, ponieważ K+ jest większy niż Na+ w porównaniu do OCl-. Ta większa odmienność między ich promieniami jonowymi sprawia, że siły elektrostatyczne występujące między nimi są mniej skuteczne..
Można również oczekiwać, że działanie tej soli w roztworze wodnym będzie podobne do działania NaOCl. Otoczony wodą K+ -bardziej obszerny - musi mieć kulkę hydratacyjną większą niż ta z Na+. W przeciwnym razie właściwości jego roztworów (kolor, zapach i siła wybielania) nie różnią się w znacznym stopniu..
Nomenklatura
Dlaczego tak nazywa się sól podchlorynu potasu? Aby odpowiedzieć na to pytanie, należy odwołać się do nazewnictwa soli trójskładnikowych regulowanego przez IUPAC. Po pierwsze, ponieważ potas ma tylko wartościowość +1, nie trzeba go zapisywać; dlatego jest ignorowany. Więc nie pisz podchlorynu potasu (I).
Kwas chlorowy ma wzór HClO3. Wraz ze spadkiem liczby atomów tlenu atom chloru zyskuje więcej elektronów; to znaczy ma mniej dodatnich wartości utleniania. Na przykład w tym kwasie Cl ma stopień utlenienia +5.
Podobnie jak w przypadku HClO, Cl ma stopień utlenienia +1, który dodatkowo ma dwie jednostki mniej atomów O (1 zamiast 3 w porównaniu z HClO3), przyrostek jego nazwy zmienia się na -oso. Podobnie, ponieważ +1 jest najmniejszym stopniem utlenienia, jaki może osiągnąć atom Cl, dodaje się przedrostek -hypo..
Tak więc HClO nazywany jest kwasem podchlorawym. Jednak KOCl jest jego solą potasową i dla stopni utlenienia Cl mniejszych niż +5 przyrostek -oso jest zamieniany na przyrostek -ito. W przeciwnym razie, dla stopni utlenienia równych lub większych niż +5, przyrostek jest zmieniany na -ate. Tak więc nazwa pozostaje podchlorynem potasu.
Nieruchomości
Masa cząsteczkowa
90,55 g / mol.
Wygląd
Jest to lekko szarawa ciecz.
Gęstość
1,16 g / cm3
Temperatura topnienia
-2 ° C (28 ° F; 271 ° K). Ta niska temperatura topnienia, pomimo jonowego charakteru jego wiązań, świadczy o słabej energii krystalicznej sieci krystalicznej czystego ciała stałego, produktu jednowartościowych ładunków K+ i OCl-, iw przeciwieństwie do jego promieni jonowych.
Temperatura wrzenia
102 ° C (216 ° F; 375 ° K). Jest tylko nieznacznie wyższy niż czysta woda.
Rozpuszczalność w wodzie
25% w / v, jest to rozsądna wartość, biorąc pod uwagę łatwość solwatacji jonów K. przez cząsteczki wody+.
Wodne roztwory podchlorynu potasu, podobnie jak NaOCl, mają właściwości wybielające. Działa drażniąco i może powodować poważne uszkodzenia w kontakcie ze skórą, oczami i błonami śluzowymi. Podobnie jego wdychanie powoduje podrażnienie oskrzeli, niewydolność oddechową i obrzęk płuc..
Reaktywność
-Podchloryn potasu jest silnym utleniaczem, którego nie uważa się za pierwiastek powodujący pożary lub wybuchy. Jednak może łączyć się z różnymi pierwiastkami chemicznymi w celu wytworzenia łatwopalnych i wybuchowych związków..
-W kontakcie z mocznikiem może tworzyć NCl3, silnie wybuchowy związek. Po podgrzaniu lub w kontakcie z kwasami wytwarza silnie toksyczny dym chlorkowy. Reaguje energicznie z węglem drzewnym w potencjalnie wybuchowej reakcji.
-Łączy się z acetylenem, tworząc wybuchowy chloroacetylen. Podobnie jego reakcja z materią organiczną, olejem, węglowodorami i alkoholami może spowodować wybuch. Jego reakcja z nitrometanem, metanolem i etanolem może stać się wybuchowa.
-Rozkłada się, uwalniając tlen, proces, który może być katalizowany przez rdzę lub metalowy pojemnik, który go zawiera..
-Podchloryn potasu należy przechowywać w niskiej temperaturze, aby uniknąć tworzenia się chloranu potasu, którego rozkład może być nawet wybuchowy..
Aplikacje
-Używany jako środek do dezynfekcji powierzchni i wody pitnej.
-Degradacja podchlorynu potasu do chlorku potasu w glebie zasugerowała jego zastosowanie w uprawach jako źródła potasu, podstawowego składnika pokarmowego dla roślin..
-Niektóre firmy sugerują jego zastosowanie jako substytutu NaOCl jako środka wybielającego, twierdząc, że ma on korzystne właściwości jonu K+ przed wpływem na środowisko powodowanym przez Na+.
Bibliografia
- Enviro Tech. Rozwiązanie wolne od sodu. [PDF]. Pobrane 29 maja 2018 z: envirotech.com
- PubChem. (2018). Podchloryn potasu. Pobrane 29 maja 2018 z: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Podchloryn potasu. Pobrane 29 maja 2018 z: en.wikipedia.org
- Książka chemiczna. (2017). Podchloryn potasu. Pobrane 29 maja 2018 r. Z: chemicalbook.com
- Whitten, Davis, Peck & Stanley. Chemia. (8th ed.). CENGAGE Learning, str. 873, 874.



Jeszcze bez komentarzy