
Historia, postulaty i przykłady teorii kinetyki molekularnej

Plik teoria kinetyki molekularnej Jest to taka, która stara się wyjaśnić eksperymentalne obserwacje gazów z perspektywy mikroskopowej. Oznacza to, że próbuje powiązać naturę i zachowanie cząstek gazowych z fizycznymi właściwościami gazu jako płynu; wyjaśnij makroskopowo od mikroskopijnego.
Gazy zawsze interesowały naukowców ze względu na ich właściwości. Zajmują całą objętość pojemnika, w którym się znajdują, mogą być całkowicie ściśnięte, a ich zawartość nie stawia najmniejszego oporu; a jeśli temperatura wzrośnie, pojemnik zacznie się rozszerzać, a nawet może pęknąć.
Wiele z tych właściwości i zachowań jest podsumowanych w prawach gazu doskonałego. Jednak uważają gaz za całość, a nie za zbiór milionów cząstek rozproszonych w przestrzeni; Ponadto, w oparciu o dane dotyczące ciśnienia, objętości i temperatury, nie dostarcza dalszych informacji dotyczących ruchu tych cząstek.
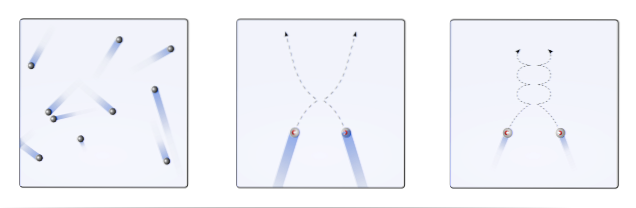
Dlatego też teoria kinetyki molekularnej (TCM) proponuje wizualizację ich jako ruchomych kul (górny obraz). Te sfery zderzają się ze sobą i ze ścianami arbitralnie i zachowują liniową trajektorię. Jednak gdy temperatura spada, a ciśnienie rośnie, trajektoria kulek staje się zakrzywiona..
Gaz według TCM powinien zachowywać się jak kule w pierwszej klatce obrazu. Ale przez ochłodzenie i zwiększenie presji na nich, ich zachowanie jest dalekie od ideału. Są wówczas gazami rzeczywistymi, które są bliskie skraplania i przechodzą w ten sposób do fazy ciekłej.
W tych warunkach interakcje między sferami stają się ważniejsze, do tego stopnia, że ich prędkości chwilowo zwalniają. Im bliżej upłynnienia, tym bardziej zakrzywione stają się ich trajektorie (wstawka po prawej stronie) i mniej energetyczne są ich zderzenia..
Indeks artykułów
- 1 Historia
- 1.1 Daniel Bernoulli
- 1.2 Rudolf Clausius
- 1.3 James Clerk Maxwell i Ludwig Boltzmann
- 2 Postulaty teorii kinetyki molekularnej
- 2.1 Objętość cząstek gazowych jest znikoma
- 2.2 Siły przyciągania między cząstkami są zerowe
- 2.3 Cząstki gazowe są zawsze w ruchu
- 2.4 Zderzenia między cząstkami a ściankami pojemnika są elastyczne
- 2.5 Energia kinetyczna nie pozostaje stała
- 2.6 Średnia energia kinetyczna jest równa danej temperaturze dla wszystkich gazów
- 3 przykłady
- 3.1 Prawo Boyle'a
- 3.2 Prawo Karola
- 3.3 Prawo Daltona
- 4 Odnośniki
Fabuła
Daniel Bernoulli
Idea tych sfer, lepiej zwanych atomami, była już rozważana przez rzymskiego filozofa Lukrecjusza; nie dla gazów, ale dla stałych, statycznych obiektów. Z drugiej strony, w 1738 roku Daniel Bernoulli zastosował wizję atomową do gazów i cieczy, wyobrażając sobie je jako nieuporządkowane sfery poruszające się we wszystkich kierunkach..
Jego praca jednak naruszała wówczas prawa fizyki; ciało nie mogło się poruszać wiecznie, więc nie można było pomyśleć, że zestaw atomów i cząsteczek zderzy się ze sobą bez utraty energii; to znaczy, istnienie zderzeń sprężystych nie było możliwe.
Rudolf clausius
Sto lat później inni autorzy wzmocnili TCM modelem, w którym cząstki gazowe poruszały się tylko w jednym kierunku. Rudolf Clausius zebrał jednak swoje wyniki i stworzył bardziej kompletny model TCM, za pomocą którego starał się wyjaśnić prawa gazu doskonałego przedstawione przez Boyle'a, Charlesa, Daltona i Avogadro..
James Clerk Maxwell i Ludwig Boltzmann
W 1859 roku James Clerk Maxwell stwierdził, że cząstki gazowe wykazują zakres prędkości w danej temperaturze i że ich zbiór można rozpatrywać za pomocą średniej prędkości cząsteczkowej..
Następnie w 1871 roku Ludwig Boltzmann połączył istniejące idee z entropią i jak gaz termodynamicznie zawsze zajmuje jak najwięcej miejsca w sposób jednorodny i spontaniczny.
Postulaty teorii kinetyki molekularnej
Aby rozpatrzyć gaz z jego cząstek, niezbędny jest model, w którym spełnione są pewne postulaty lub założenia; postuluje, że logicznie musi być w stanie przewidzieć i wyjaśnić (jak najdokładniej) obserwacje makroskopowe i eksperymentalne. To powiedziawszy, postulaty TCM są wspomniane i opisane.
Objętość cząstek gazowych jest znikoma
W pojemniku wypełnionym cząstkami gazowymi te rozpraszają się i oddalają od siebie we wszystkich rogach. Gdyby przez chwilę wszystkie mogły zostać zebrane razem w określonym miejscu pojemnika, bez skraplania, to można by zauważyć, że zajmują one jedynie znikomą część objętości pojemnika..
Oznacza to, że pojemnik, nawet jeśli zawiera miliony cząstek gazowych, jest w rzeczywistości bardziej pusty niż pełny (stosunek objętości do pustej przestrzeni znacznie mniejszy niż 1); dlatego, jeśli pozwalają na to bariery, on i znajdujący się w nim gaz mogą zostać gwałtownie sprężone; ponieważ pod koniec dnia cząsteczki są bardzo małe, podobnie jak ich objętość.
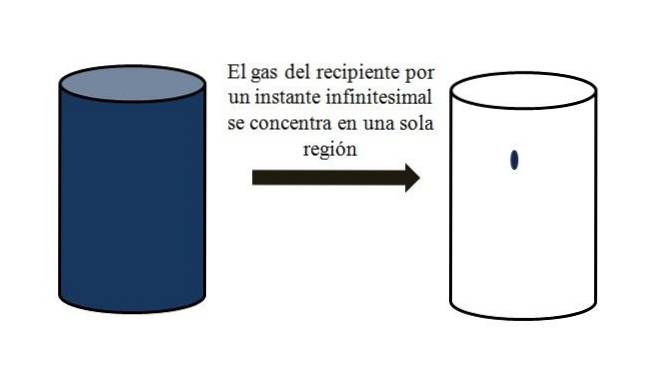
Górny obraz dokładnie ilustruje powyższe, używając niebieskawego gazu.
Siły przyciągania między cząstkami wynoszą zero
Cząstki gazowe wewnątrz pojemnika zderzają się ze sobą bez wystarczającej ilości czasu, aby ich interakcje nabrały siły; jeszcze mniej, gdy to, co je otacza, to próżnia molekularna. Bezpośrednią tego konsekwencją jest to, że ich liniowe ścieżki pozwalają im całkowicie objąć objętość pojemnika..
Gdyby tak nie było, pojemnik o „dziwacznym” i „labiryntowym” kształcie miałby wilgotne obszary w wyniku kondensacji gazu; zamiast tego cząsteczki poruszają się po pojemniku z pełną swobodą, bez siły ich interakcji, która je powstrzymuje.
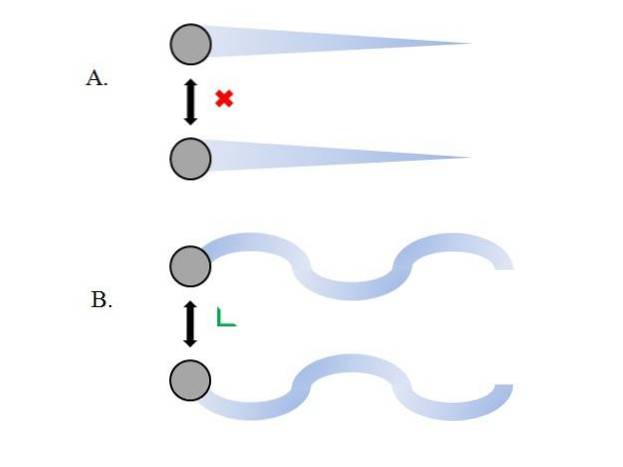
Liniowe trajektorie górnego obrazu (A.) demonstrują ten postulat; podczas gdy trajektorie są zakrzywione (B.), pokazuje to, że istnieją interakcje, których nie można zignorować między cząstkami.
Cząstki gazowe są zawsze w ruchu
Z dwóch pierwszych postulatów zbiega się również fakt, że cząsteczki gazu nigdy nie przestają się poruszać. Rozmyte w pojemniku zderzają się ze sobą iz jego ściankami z siłą i prędkością wprost proporcjonalną do temperatury bezwzględnej; tą siłą jest ciśnienie.
Gdyby cząsteczki gazu przestały się na chwilę poruszać, wewnątrz pojemnika pojawiłyby się „jęzory dymu”, wynurzające się znikąd, z wystarczającą ilością czasu, aby ułożyć się w próżni i nadać przypadkowe kształty..
Zderzenia między cząstkami a ściankami pojemnika są elastyczne
Jeśli wewnątrz pojemnika dominować będą tylko elastyczne zderzenia między cząstkami gazowymi a ściankami pojemnika, kondensacja gazu nigdy nie nastąpi (o ile warunki fizyczne nie ulegną zmianie); lub co jest tym samym, co powiedzenie, że nigdy nie odpoczywają i zawsze się zderzają.
Dzieje się tak, ponieważ w zderzeniach sprężystych nie ma utraty netto energii kinetycznej; cząstka zderza się ze ścianą i odbija się z tą samą prędkością. Jeśli zderzająca się cząstka zwalnia, druga przyspiesza, nie wytwarzając ciepła ani dźwięku, który rozprasza energię kinetyczną któregokolwiek z nich.
Energia kinetyczna nie pozostaje stała
Ruch cząstek jest przypadkowy i chaotyczny, tak że nie wszystkie mają taką samą prędkość; tak jak to się dzieje, na przykład na autostradzie lub w tłumie. Niektóre są bardziej energiczne i podróżują szybciej, podczas gdy inne są powolne, czekając na kolizję, aby je przyspieszyć.
Aby opisać jego prędkość, konieczne jest obliczenie średniej; i dzięki temu z kolei uzyskuje się średnią energię kinetyczną cząstek lub cząsteczek gazowych. Ponieważ energia kinetyczna wszystkich cząstek stale się zmienia, średnia pozwala na lepszą kontrolę danych i może być przetwarzana z większą niezawodnością..
Średnia energia kinetyczna jest równa danej temperaturze dla wszystkich gazów
Średnia molekularna energia kinetyczna (ECposeł) w pojemniku zmienia się wraz z temperaturą. Im wyższa temperatura, tym wyższa będzie energia. Ponieważ jest to średnia, mogą istnieć cząstki lub gazy, które mają wyższą lub niższą energię niż ta wartość; odpowiednio szybsze i wolniejsze.
Matematycznie można wykazać, że ECposeł zależy to wyłącznie od temperatury. Oznacza to, że bez względu na to, czym jest gaz, jego masę lub strukturę molekularną, jego ECposeł będzie taka sama w temperaturze T i będzie się zmieniać tylko wtedy, gdy wzrośnie lub spadnie. Ze wszystkich postulatów jest to chyba najbardziej istotne..
A co ze średnią prędkością molekularną? W przeciwieństwie do ECposeł, masa cząsteczkowa wpływa na prędkość. Im cięższa cząsteczka lub molekuła gazowa, tym naturalne jest oczekiwanie, że będzie się ona poruszać wolniej..
Przykłady
Oto kilka krótkich przykładów tego, jak TCM zdołał wyjaśnić prawa dotyczące gazu doskonałego. Chociaż nie zostało to uwzględnione, inne zjawiska, takie jak dyfuzja gazów i wysięk, można również wyjaśnić za pomocą TCM.
Prawo Boyle'a
Jeśli objętość pojemnika jest ściskana przy stałej temperaturze, odległość, jaką muszą pokonać cząstki gazowe, aby zderzyć się ze ścianami, maleje; co jest równoznaczne ze wzrostem częstotliwości takich zderzeń, skutkującym większym ciśnieniem. Ponieważ temperatura pozostaje stała, ECposeł jest również stała.
Charles Law
Jeśli zwiększysz T, ECposeł wzrośnie. Cząstki gazowe będą poruszać się szybciej i zderzać się z większą liczbą razy ze ściankami pojemnika; więc ciśnienie wzrasta.
Jeśli ściany są elastyczne, mogą się rozszerzać, ich powierzchnia zwiększy się, a ciśnienie spadnie, aż stanie się stałe; w rezultacie głośność również wzrośnie.
Prawo Daltona
Gdyby do obszernego pojemnika, pochodzącego z mniejszych zbiorników, dodano kilka litrów różnych gazów, jego całkowite ciśnienie wewnętrzne byłoby równe sumie ciśnień cząstkowych wywieranych przez każdy rodzaj gazu z osobna..
Dlaczego? Ponieważ wszystkie gazy zaczynają zderzać się ze sobą i rozpraszać się równomiernie; interakcje między nimi są zerowe, a podciśnienie dominuje w zbiorniku (postuluje TCM), czyli tak jakby każdy gaz był sam, wywierając swoje ciśnienie indywidualnie bez ingerencji innych gazów.
Bibliografia
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning, P 426-431.
- Fernandez Pablo. (2019). Teoria kinetyki molekularnej. Vix. Odzyskany z: vix.com
- Jones, Andrew Zimmerman. (7 lutego 2019). Kinetyczno-molekularna teoria gazów. Odzyskany z: thinkco.com
- Hall Nancy. (5 maja 2015). Kinetyczna teoria gazów. Glenn Research Center. Odzyskany z: grc.nasa.gov
- Blaber M. & Lower S. (09 października 2018). Podstawy kinetycznej teorii molekularnej. Chemia LibreTexts. Źródło: chem.libretexts.org
- Teoria molekularna kinetyki. Odzyskany z: chemed.chem.purdue.edu
- Wikipedia. (2019). Kinetyczna teoria gazów. Odzyskane z: en.wikipedia.org
- Toppr. (s.f.). Kinetyczna molekularna teoria gazów. Odzyskany z: toppr.com


Jeszcze bez komentarzy