
Charakterystyka, budowa, rodzaje i funkcje histonów
Plik histony to podstawowe białka, które oddziałują z DNA w celu tworzenia nukleosomów, które tworzą nici chromatyny tworzące chromosomy w organizmach eukariotycznych.
Nukleosomy, kompleksy złożone z DNA i białek, odkryto w 1974 roku i to histony tworzą ten podstawowy poziom organizacji chromatyny. Jednak istnienie białek histonowych było znane od lat sześćdziesiątych XX wieku..
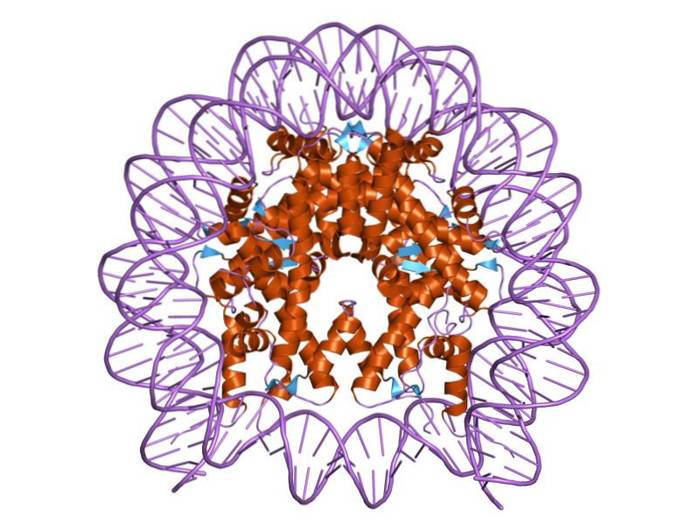
Histony są zorganizowane w taki sposób, że dwupasmowe DNA otacza centrum białkowe zbudowane z tych białek, które ściśle ze sobą oddziałują. Środek histonu ma kształt dysku, a DNA okrąża go około 1,7 raza..
Wiele wiązań wodorowych umożliwia DNA wiązanie się z centrum białka utworzonym przez histony w każdym nukleosomie. Wiązania te powstają w większości między szkieletami aminokwasowymi histonów a szkieletem cukrowo-fosforanowym DNA. Uczestniczą również w niektórych oddziaływaniach hydrofobowych i wiązaniach jonowych.
Białka znane jako „kompleksy remodelujące chromatynę” są odpowiedzialne za rozpad i tworzenie wiązań połączeniowych między DNA i histonami, umożliwiając wejście mechanizmu transkrypcyjnego do DNA zawartego w nukleosomach.
Pomimo bliskości kwasów nukleinowych do centrum białka utworzonego przez histony, są one ułożone w taki sposób, że w razie potrzeby umożliwiają wejście czynników transkrypcyjnych i innych białek związanych z ekspresją genów lub wyciszaniem genów..
Histony mogą podlegać różnym modyfikacjom, które generują wiele wariantów, umożliwiając istnienie wielu różnych form chromatyny, które mają właściwość modulowania ekspresji genów na różne sposoby..
Indeks artykułów
- 1 Funkcje
- 2 Struktura
- 2.1 Wiązanie histonów
- 3 rodzaje
- 3.1 Histony nukleosomalne
- 3.2 Wiążące histony
- 4 Funkcje
- 5 Referencje
Charakterystyka
Są jednym z najbardziej konserwatywnych białek eukariotycznych w przyrodzie. Na przykład wykazano, że histon H4 grochu różni się tylko w dwóch z 102 pozycji aminokwasów krowiego białka H4..
Histony to stosunkowo małe białka, zawierające nie więcej niż 140 aminokwasów. Są bogate w podstawowe reszty aminokwasowe, więc mają dodatni ładunek netto, który przyczynia się do ich interakcji z ujemnie naładowanym kwasem nukleinowym w celu utworzenia nukleosomów..
Znane są histony nukleosomalne i mostkujące. Histony nukleosomalne to H3, H4, H2A i H2B, natomiast histony wiążące należą do rodziny histonów H1.
Podczas składania nukleosomów początkowo powstają specyficzne dimery H3-H4 i H2A-H2B. Następnie dwa dimery H3-H4 łączą się ze sobą, tworząc tetramery, które później łączą się z dimerami H2A-H2B, tworząc oktameryczne centrum..
Wszystkie histony są syntetyzowane głównie w fazie S cyklu komórkowego, a nukleosomy są składane w powstających helisach DNA, tuż za widełkami replikacyjnymi..
Struktura
Ogólna struktura histonów obejmuje zasadowy region aminokwasowy i globularny region karboksylowy silnie konserwowany wśród organizmów eukariotycznych..
Motyw strukturalny znany jako „fałd histonowy”, składający się z trzech helis alfa połączonych dwoma szpilkami do włosów i tworzących małe centrum hydrofobowe, jest odpowiedzialny za interakcje białko-białko między histonami tworzącymi nukleosom..
To właśnie ten fałd histonów tworzy globularną domenę karboksylową tych białek nukleosomalnych u wszystkich eukariontów..
Histony mają również małe „ogony” lub regiony końca aminowego i inne regiony na końcu karboksylowym (dostępne dla proteaz), nie dłuższe niż 40 aminokwasów. Oba regiony są bogate w podstawowe aminokwasy, które mogą podlegać wielu potranslacyjnym modyfikacjom kowalencyjnym..
Wiążące histony
U eukariontów istnieją dwie rodziny wiążących histonów, różniące się od siebie budową. Niektóre mają strukturę trójdzielną, z opisaną powyżej domeną kulistą otoczoną przez „niestrukturalne” domeny N- i C-końcowe; podczas gdy inne mają tylko domenę C-końcową.
Chociaż większość histonów jest konserwowana, specyficzne warianty mogą pojawić się podczas embriogenezy lub dojrzewania wyspecjalizowanych komórek w niektórych organizmach. Niektóre różnice strukturalne mają związek z modyfikacjami potranslacyjnymi, takimi jak:
-Fosforylacja: uważa się, że ma to związek z modyfikacją stopnia kondensacji chromatyny i występuje powszechnie w resztach seryny.
-Acetylacja: związane z regionami chromosomowymi, które są aktywne transkrypcyjnie. Zwykle występuje na łańcuchach bocznych reszt lizyny. Występując na tych resztach ich dodatni ładunek maleje, zmniejszając tym samym powinowactwo białek do DNA..
-Metylacja: może wystąpić jako mono-, di- lub trimetylacja reszt lizyny wystających z rdzenia białkowego.
Za te kowalencyjne modyfikacje histonów odpowiedzialne są określone enzymy. Enzymy te obejmują histon-acetylotransferazy (HAT), kompleksy histon-deacetylazy (HDAC) oraz histon-metylotransferazy i demetylazy..
Rodzaje
Charakterystyka histonów została przeprowadzona różnymi technikami biochemicznymi, wśród których wyróżniają się chromatografie oparte na słabych żywicach kationowymiennych..
Niektórzy autorzy ustalają formę klasyfikacji, w której wyróżnia się 5 głównych typów histonów u eukariontów: FI, z białkami 21 kDa; F2A1 lub FIV plus lub minus 11,3 kDa; F2A2 lub FIIbI, 14,5 kDa; F2B lub FIIb2 o masie cząsteczkowej 13,7 kDa i F3 lub FIII 15,3 kDa.
Wszystkie te typy histonów, z wyjątkiem grupy IF, znajdują się w równomolowych ilościach w komórkach..
Inna klasyfikacja, z tą samą trafnością i być może najszerzej stosowaną obecnie, proponuje istnienie dwóch różnych typów histonów, a mianowicie: tych, które są częścią oktameru nukleosomu oraz histonów wiążących lub mostkujących, które łączą nukleosomy pomiędzy Tak.
Niektóre warianty mogą również występować między gatunkami iw przeciwieństwie do histonów rdzeniowych, warianty są syntetyzowane podczas interfazy i są wprowadzane do wstępnie uformowanej chromatyny w procesie zależnym od energii uwolnionej z hydrolizy ATP..
Histony nukleosomalne
Środek nukleosomu składa się z pary każdego z czterech składowych histonów: H2a, H2b, H3 i H4; na które nawinięte są segmenty DNA o około 145 parach zasad.
Histony H4 i H2B są w zasadzie niezmienne. Jednak widoczne są pewne różnice w histonach H3 i H2A, których właściwości biofizyczne i biochemiczne zmieniają normalny charakter nukleosomu..
Odmiana histonu H2A u ludzi, białko H2A.Z ma duży region kwasowy i może sprzyjać stabilności nukleosomu w zależności od wariantów histonu H3, z którymi jest związane..
Te histony wykazują pewną zmienność między gatunkami, przy czym szczególnym przypadkiem jest histon H2B, w przypadku którego pierwsza trzecia cząsteczki jest bardzo zmienna..
Wiążące histony
Histony wiążące lub mostkujące to histony klasy H1. Są one odpowiedzialne za zjednoczenie nukleosomów i ochronę DNA, które wystaje na początku i na końcu każdej cząstki..
W przeciwieństwie do histonów nukleosomalnych, nie wszystkie histony typu H1 posiadają globularny region „fałdu” histonu. Białka te wiążą się z DNA między nukleosomami, ułatwiając zmianę równowagi chromatyny w kierunku bardziej skondensowanego i mniej aktywnego stanu, mówiąc transkrypcyjnie..
Badania powiązały te histony ze starzeniem się, naprawą DNA i procesami apoptotycznymi, dlatego uważa się, że odgrywają kluczową rolę w utrzymaniu integralności genomu.
funkcje
Wszystkie reszty aminokwasowe histonów w taki czy inny sposób uczestniczą w ich interakcji z DNA, co wyjaśnia fakt, że są tak konserwatywne wśród królestw organizmów eukariotycznych.
Udział histonów w pakowaniu DNA w postaci chromatyny ma ogromne znaczenie dla złożonych organizmów wielokomórkowych, w których różne linie komórkowe mogą specjalizować się jedynie poprzez zmianę dostępności ich genów dla mechanizmu transkrypcyjnego..
Aktywne transkrypcyjnie regiony genomowe są gęste w nukleosomach, co sugeruje, że połączenie DNA z białkami histonowymi ma kluczowe znaczenie dla negatywnej lub pozytywnej regulacji ich transkrypcji..
Podobnie, przez całe życie komórki reakcja na dużą liczbę bodźców, zarówno wewnętrznych, jak i zewnętrznych, zależy od niewielkich zmian w chromatynie, które zwykle mają związek z przebudową i potranslacyjną modyfikacją histonów znajdujących się w bliskim związku z DNA.
Wiele zmiennych histonowych pełni różne funkcje u eukariontów. Jeden z nich dotyczy udziału wariantu histonu H3 w tworzeniu struktur centromerowych odpowiedzialnych za segregację chromosomów podczas mitozy..
Wykazano, że odpowiednik tego białka u innych eukariotów jest niezbędny do tworzenia kinetochoru białka, z którym wiążą się mikrotubule wrzeciona podczas mitozy i mejozy..
Bibliografia
- Alberts, B., Johnson, A., Lewis, J., Morgan, D., Raff, M., Roberts, K. i Walter, P. (2015). Biologia molekularna komórki (6th ed.). Nowy Jork: Garland Science.
- Campos, E. I. i Reinberg, D. (2009). Histony: opisująca chromatynę. Annu. Rev. Genet., 43, 559-599.
- Harvey, A. C. i Downs, J. A. (2004). Jakie funkcje zapewniają histony linkerów? Mikrobiologia molekularna, 53, 771-775.
- Henikoff, S. i Ahmad, K. (2005). Składanie odmian histonów w chromatynę. Annu. Rev. Cell. Dev. Biol., dwadzieścia jeden, 133-153.
- Isenberg, I. (1979). Histony. Annu. Rev. Biochem., 48, 159-191.
- Kornberg, R. D. i Thomas, J. O. (1974). Struktura chromatyny: Oligomery histonów. Nauka, 184(4139), 865-868.
- Smith, E., DeLange, R. i Bonner, J. (1970). Chemia i biologia histonów. Recenzje fizjologiczne, pięćdziesiąt(2), 159-170.



Jeszcze bez komentarzy