
Procesy izomerazy, funkcje, nazewnictwo i podklasy
Plik izomerazy Stanowią klasę enzymów zaangażowanych w strukturalne lub pozycyjne przegrupowanie izomerów i stereoizomerów różnych cząsteczek. Występują praktycznie we wszystkich organizmach komórkowych pełniących funkcje w różnych kontekstach.
Enzymy z tej klasy działają na pojedynczym substracie, chociaż niektóre mogą być kowalencyjnie związane m.in. z kofaktorami, jonami. Zatem ogólną reakcję można zobaczyć w następujący sposób:
X-Y → Y-X
Reakcje katalizowane przez te enzymy obejmują wewnętrzne przegrupowanie wiązań, co może oznaczać zmiany położenia grup funkcyjnych, między innymi w położeniu wiązań podwójnych między atomami węgla, bez zmiany wzoru cząsteczkowego substratu..
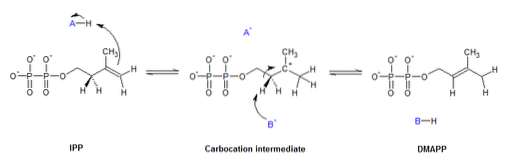
Izomerazy pełnią różne funkcje w wielu różnych procesach biologicznych, w tym na szlakach metabolicznych, podziale komórek, replikacji DNA, by wymienić tylko kilka..
Izomerazy były pierwszymi enzymami stosowanymi przemysłowo do produkcji syropów i innych słodkich pokarmów, dzięki ich zdolności do wzajemnej przemiany izomerów różnych rodzajów węglowodanów.
Indeks artykułów
- 1 Procesy biologiczne, w których uczestniczą
- 2 Funkcje
- 3 Nazewnictwo
- 4 podklasy
- 4.1 EC.5.1 Racemases i epimerazy
- 4.2 EC.5.2 Izomerazy cis-trans
- 4.3 EC.5.3 Izomerazy wewnątrzcząsteczkowe
- 4.4 EC.5.4 Transferazy wewnątrzcząsteczkowe (mutazy)
- 4.5 EC.5.5 Liazy wewnątrzcząsteczkowe
- 4.6 EC.5.6 Izomerazy zmieniające konformację makrocząsteczkową
- 4.7 EC.5.99 Inne izomerazy
- 5 Referencje
Procesy biologiczne, w których uczestniczą
Izomerazy uczestniczą w wielu ważnych procesach komórkowych. Do najważniejszych należą replikacja i pakowanie DNA, katalizowane przez topoizomerazy. Zdarzenia te są kluczowe dla replikacji kwasu nukleinowego, a także dla jego kondensacji przed podziałem komórki..
Glikoliza, jeden z głównych szlaków metabolicznych w komórce, obejmuje co najmniej trzy izomeryczne enzymy, a mianowicie: izomerazę fosfoglukozy, izomerazę triozofosforanową i mutazę fosfoglicerynianową..
Przekształcenie galaktozy UDP w glukozę UDP w szlaku katabolizmu galaktozy odbywa się poprzez działanie epimerazy. U ludzi enzym ten jest znany jako 4-epimeraza UDP-glukozy..
Fałdowanie białek jest procesem niezbędnym do funkcjonowania wielu enzymów w przyrodzie. Enzym izomeraza disiarczkowo-białkowa pomaga w fałdowaniu białek zawierających mostki dwusiarczkowe poprzez modyfikację ich pozycji w cząsteczkach, których używa jako substratów..
funkcje
Główną funkcję enzymów należących do klasy izomerazy można postrzegać jako przekształcanie substratu poprzez niewielką zmianę strukturalną, aby uczynić go podatnym na dalsze przetwarzanie przez enzymy znajdujące się poniżej szlaku metabolicznego, na przykład.
Przykładem izomeryzacji jest zmiana z grupy fosforanowej w pozycji 3 na węgiel w pozycji 2 3-fosfoglicerynianu w celu przekształcenia go w 2-fosfoglicerynian, katalizowanej przez enzym mutazę fosfoglicerynianową na szlaku glikolitycznym, generując w ten sposób związek o wyższej energii czym jest funkcjonalny substrat enolazy.
Nomenklatura
Klasyfikacja izomerazy jest zgodna z ogólnymi zasadami klasyfikacji enzymów zaproponowanymi przez Komisję ds. Enzymów (Komisja ds. Enzymów) w 1961 r., w którym każdy enzym otrzymuje kod numeryczny do swojej klasyfikacji.
Umiejscowienie numerów we wspomnianym kodzie wskazuje na każdy z działów lub kategorii w klasyfikacji, a numery te są poprzedzone literami „WE”.
W przypadku izomerazy pierwsza liczba oznacza klasę enzymatyczną, druga oznacza typ izomeryzacji, którą wykonują, a trzecia substrat, na którym oddziałują..
Nazewnictwo klas izomerazy to EC.5. Ma siedem podklas, więc zostaną znalezione enzymy o kodzie od EC.5.1 do EC.5.6. Istnieje szósta „podklasa” izomerazy znana jako „inne izomerazy”, której kod to EC.5.99, ponieważ obejmuje enzymy o różnych funkcjach izomerazy..
Oznaczenie podklas odbywa się głównie w zależności od rodzaju izomeryzacji, którą wykonują te enzymy. Mimo to mogą również otrzymywać nazwy, takie jak racemazy, epimerazy, cis-trans-izomerazy, izomerazy, tautomerazy, mutazy lub cykloizomerazy.
Podklasy
W rodzinie izomerazy istnieje 7 klas enzymów:
EC.5.1 Racemases i epimerazy
Katalizują tworzenie mieszanin racemicznych w oparciu o położenie węgla α. Mogą działać na aminokwasy i pochodne (EC.5.1.1), na grupy hydroksykwasowe i pochodne (EC.5.1.2), na węglowodany i pochodne (EC.5.1.3) i inne (EC.5.1.99).
EC.5.2 Cis-trans-Izomerazy
Katalizować konwersję między formami izomerycznymi cis Y przeł różnych cząsteczek.
EC.5.3 Izomerazy wewnątrzcząsteczkowe
Enzymy te są odpowiedzialne za izomeryzację wewnętrznych części tej samej cząsteczki. Są takie, które wykonują reakcje redoks, w których donorem i akceptorem elektronów jest ta sama cząsteczka, więc nie są klasyfikowane jako oksydoreduktazy.
Mogą działać poprzez konwersję aldoz i ketoz (EC.5.3.1), na grupy keto- i enolowe (EC.5.3.2), zmieniając pozycję wiązań podwójnych CC (EC.5.3.3), wiązań dwusiarczkowych SS (EC.5.3.4) i inne „oksydoreduktazy” (EC.5.3.99).
EC.5.4 Transferazy wewnątrzcząsteczkowe (mutazy)
Enzymy te katalizują zmiany pozycji różnych grup w tej samej cząsteczce. Są klasyfikowani zgodnie z typem grupy, którą „przenoszą”.
Istnieją fosfomutazy (EC.5.4.1), te, które przenoszą grupy aminowe (EC.5.4.2), te, które przenoszą grupy hydroksylowe (EC.5.4.3) i te, które przenoszą inne typy grup (EC.5.4 99).
EC.5.5 Liazy wewnątrzcząsteczkowe
Katalizują „eliminację” grupy, która jest częścią cząsteczki, ale nadal jest z nią kowalencyjnie związana.
EC.5.6 Izomerazy zmieniające konformację makrocząsteczkową
Mogą działać poprzez zmianę konformacji polipeptydów (EC.5.6.1) lub kwasów nukleinowych (EC.5.6.2).
EC.5.99 Inne izomerazy
Ta podklasa obejmuje enzymy, takie jak izomeraza tiocyjanianowa i izomeraza 2-hydroksychrom-2-karboksylanowa..
Bibliografia
- Adams, E. (1972). Aminokwasy Racemazy i epimerazy. Enzymy, 6, 479-507.
- Boyce, S. i College, T. (2005). Klasyfikacja i nazewnictwo enzymów. Encyklopedia nauk o życiu, 1-11.
- Cai, C. Z., Han, L. Y., Ji, Z. L. i Chen, Y. Z. (2004). Klasyfikacja rodzin enzymów według maszyn wektorów nośnych. Białka: struktura, funkcja i bioinformatyka, 55, 66-76.
- Dugave, C. i Demange, L. (2003). Izomeryzacja Cis - Trans cząsteczek organicznych i biomolekuł: implikacje i zastosowania. Recenzje chemiczne, 103, 2475-2532.
- Encyklopedia Britannica. (2018). Pobrano 3 marca 2019 r. Z witryny britannica.com
- Freedman, R. B., Hirst, T. R., & Tuite, M. F. (1994). Izomeraza disiarczku białka: budowanie mostów w fałdowaniu białek. TIBS, 19, 331-336.
- Murzin, A. (1996). Strukturalna klasyfikacja białek: nowe nadrodziny Alexey G Murzin. Strukturalna klasyfikacja białek: nowe nadrodziny, 6, 386-394.
- Nelson, D. L. i Cox, M. M. (2009). Zasady Lehningera biochemii. Wydania Omega (Wyd. 5).
- Komitet ds. Nomenklatury Międzynarodowej Unii Biochemii i Biologii Molekularnej (NC-IUBMB). (2019). Odzyskany z qmul.ac.uk
- Thoden, J. B., Frey, P. A. i Holden, H. M. (1996). Struktura molekularna poronnego kompleksu NADH / UDP-glukoza 4-epimerazy galaktozy UDP z Escherichia coli: implikacje dla mechanizmu katalitycznego. Biochemia, 35, 5137-5144.


Jeszcze bez komentarzy