
Eksperymenty i przykłady prawa zachowania materii

Plik prawo zachowania materii lub masy To taki, który dowodzi, że w każdej reakcji chemicznej materia nie jest ani tworzona, ani niszczona. Prawo to opiera się na fakcie, że atomy są niepodzielnymi cząstkami w tego typu reakcji; podczas gdy w reakcjach jądrowych atomy ulegają fragmentacji, dlatego reakcje chemiczne nie są brane pod uwagę.
Jeśli atomy nie zostaną zniszczone, to gdy reaguje pierwiastek lub związek, liczba atomów przed i po reakcji musi być stała; co przekłada się na stałą masę między reagentami i zaangażowanymi produktami.
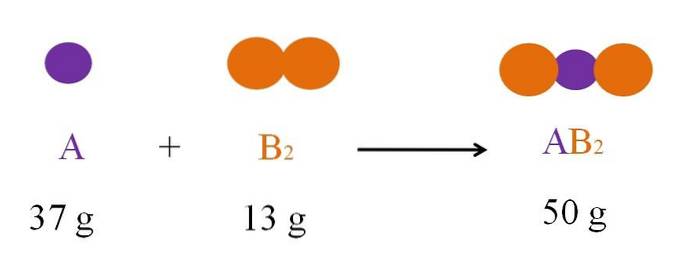
Dzieje się tak zawsze, gdy nie ma wycieku, który powoduje utratę materiału; ale jeśli reaktor jest hermetycznie zamknięty, żaden atom "nie znika", a zatem naładowana masa musi być równa masie po reakcji.
Z drugiej strony, jeśli produkt jest stały, jego masa będzie równa sumie reagentów zaangażowanych w jego tworzenie. To samo dzieje się z produktami ciekłymi lub gazowymi, ale bardziej podatne jest na pomyłki przy pomiarze ich masy wynikowej..
Prawo to zrodziło się z eksperymentów w minionych stuleciach i zostało wzmocnione wkładem różnych znanych chemików, takich jak Antoine Lavoisier..
Rozważ reakcję między A i B.dwa tworząc ABdwa (górne zdjęcie). Zgodnie z prawem zachowania materii masa ABdwa musi być równa sumie mas A i B.dwa, odpowiednio. Więc jeśli 37 g A reaguje z 13 g Bdwa, produkt ABdwa musi ważyć 50g.
Dlatego w równaniu chemicznym masa reagentów (A i Bdwa) musi być zawsze równa masie produktów (ABdwa).
Przykładem bardzo podobnym do opisanego powyżej jest tworzenie się tlenków metali, takich jak rdza lub rdza. Rdza jest cięższa od żelaza (chociaż może się tak nie wydawać), ponieważ metal zareagował z masą tlenu, tworząc tlenek.
Indeks artykułów
- 1 Jakie jest prawo zachowania materii lub masy??
- 1.1 Wkład Lavoisiera
- 2 Jak to prawo jest stosowane w równaniu chemicznym?
- 2.1 Podstawowe zasady
- 2.2 Równanie chemiczne
- 3 Eksperymenty potwierdzające prawo
- 3.1 Spalanie metali
- 3.2 Uwolnienie tlenu
- 4 przykłady (ćwiczenia praktyczne)
- 4.1 Rozkład tlenku rtęci
- 4.2 Spalanie taśmy magnezowej
- 4.3 Wodorotlenek wapnia
- 4.4 Tlenek miedzi
- 4.5 Tworzenie chlorku sodu
- 5 Referencje
Jakie jest prawo zachowania materii lub masy??
Prawo to stanowi, że w reakcji chemicznej masa reagentów jest równa masie produktów. Prawo wyraża się w zdaniu „materia nie jest ani tworzona, ani niszczona, wszystko jest przekształcane”, jak ogłosił Julius Von Mayer (1814–1878)..
Prawo zostało opracowane niezależnie przez Michaiła Lamanosowa w 1745 r. I Antoine Lavoisier w 1785 r. Chociaż prace badawcze Lamanosova nad Prawem zachowania masy były starsze niż Lavoisier, nie były one znane w Europie z tego, że zostały napisane w języku rosyjskim.
Eksperymenty przeprowadzone w 1676 roku przez Roberta Boyle'a doprowadziły ich do wskazania, że kiedy materiał został spalony w otwartym pojemniku, masa materiału wzrosła; być może z powodu przemiany, której doświadczył sam materiał.
Eksperymenty Lavoisera dotyczące spalania materiałów w pojemnikach z ograniczonym wlotem powietrza wykazały przyrost masy. Wynik ten był zgodny z wynikiem uzyskanym przez Boyle'a.
Wkład Lavoisiera
Jednak wniosek Lavoisiera był inny. Uważał, że podczas spalania z powietrza wydobywa się pewną ilość masy, co tłumaczy wzrost masy, jaki zaobserwowano w materiałach poddawanych spalaniu..
Lavoiser uważał, że masa metali pozostaje stała podczas spalania, a spadek spalania w zamkniętych pojemnikach nie jest spowodowany zmniejszeniem luźnej (nieużywanej koncepcji), rzekomej istoty związanej z wytwarzaniem ciepła..
Lavoiser zwrócił uwagę, że obserwowany spadek spowodowany był raczej spadkiem stężenia gazów w zamkniętych zbiornikach..
Jak to prawo jest stosowane w równaniu chemicznym?
Prawo zachowania masy ma transcendentalne znaczenie w stechiometrii, przy czym ta ostatnia jest definiowana jako obliczanie zależności ilościowych między reagentami a produktami obecnymi w reakcji chemicznej..
Zasady stechiometrii zostały ogłoszone w 1792 roku przez Jeremíasa Benjamina Richtera (1762-1807), który zdefiniował ją jako naukę mierzącą ilościowe proporcje lub stosunki masowe pierwiastków chemicznych biorących udział w reakcji..
W reakcji chemicznej dochodzi do modyfikacji substancji, które w niej uczestniczą. Obserwuje się, że reagenty lub reagenty są zużywane w celu wytworzenia produktów.
Podczas reakcji chemicznej dochodzi do zerwania wiązań między atomami, a także do powstania nowych wiązań; ale liczba atomów biorących udział w reakcji pozostaje niezmieniona. Nazywa się to prawem zachowania materii.
Podstawowe zasady
Prawo to implikuje dwie podstawowe zasady:
-Całkowita liczba atomów każdego typu jest równa w reagentach (przed reakcją) i w produktach (po reakcji).
-Suma ładunków elektrycznych przed i po reakcji pozostaje stała.
Dzieje się tak, ponieważ liczba cząstek subatomowych pozostaje stała. Cząstki te to neutrony bez ładunku elektrycznego, dodatnio naładowane protony (+) i ujemnie naładowane elektrony (-). Zatem ładunek elektryczny nie zmienia się podczas reakcji.
Równanie chemiczne
Mając powyższe na uwadze, przedstawiając reakcję chemiczną za pomocą równania (takiego jak to na głównym obrazie), należy przestrzegać podstawowych zasad. Równanie chemiczne wykorzystuje symbole lub reprezentacje różnych pierwiastków lub atomów oraz sposób ich grupowania w cząsteczki przed lub po reakcji.
Poniższe równanie zostanie użyte ponownie jako przykład:
A + Bdwa => ABdwa
Indeks dolny to liczba umieszczana po prawej stronie elementów (Bdwa i ABdwa) w jej dolnej części, wskazując liczbę atomów pierwiastka obecnego w cząsteczce. Tej liczby nie można zmienić bez wytworzenia nowej cząsteczki, innej niż pierwotna..
Współczynnik stechiometryczny (1, w przypadku A i pozostałych gatunków) to liczba umieszczona po lewej stronie atomów lub cząsteczek, wskazująca liczbę z nich biorących udział w reakcji.
W równaniu chemicznym, jeśli reakcja jest nieodwracalna, umieszcza się pojedynczą strzałkę, która wskazuje kierunek reakcji. Jeśli reakcja jest odwracalna, są dwie strzałki w przeciwnym kierunku. Po lewej stronie strzałek znajdują się odczynniki lub reagenty (A i Bdwa), a po prawej produkty (ABdwa).
Wahadłowy
Bilansowanie równania chemicznego to procedura, która umożliwia zrównanie liczby atomów pierwiastków chemicznych obecnych w reagentach z liczbą atomów w produktach.
Innymi słowy, liczba atomów każdego pierwiastka musi być taka sama po stronie reagentów (przed strzałką) i po stronie produktów reakcji (za strzałką).
Mówi się, że kiedy reakcja jest zrównoważona, przestrzega się prawa zbiorowego działania.
Dlatego ważne jest, aby zrównoważyć liczbę atomów i ładunki elektryczne po obu stronach strzałki w równaniu chemicznym. Podobnie suma mas reagentów musi być równa sumie mas produktów.
W przypadku przedstawionego równania jest już zbilansowane (równa liczba A i B po obu stronach strzałki).
Eksperymenty, które potwierdzają prawo
Spalanie metali
Lavoiser, obserwując spalanie metali takich jak ołów i cyna w zamkniętych pojemnikach z ograniczonym dopływem powietrza, zauważył, że metale były pokryte kalcynacją; a ponadto, że waga metalu w danym momencie ogrzewania była równa początkowej.
Ponieważ podczas spalania metalu obserwuje się przyrost masy ciała, Lavoiser pomyślał, że zaobserwowaną nadwagę można wytłumaczyć pewną masą czegoś, co jest usuwane z powietrza podczas spalania. Z tego powodu masa pozostała stała.
Ten wniosek, który można by rozpatrywać na błędnych podstawach naukowych, nie jest taki, biorąc pod uwagę wiedzę, jaką Lavoiser posiadał o istnieniu tlenu w czasie, gdy ogłaszał swoje Prawo (1785).
Uwolnienie tlenu
Tlen został odkryty przez Carla Willhelma Scheele w 1772 roku. Później Joseph Priesley odkrył go niezależnie i opublikował wyniki swoich badań, trzy lata przed opublikowaniem przez Scheele swoich wyników dotyczących tego samego gazu..
Priesley ogrzał tlenek rtęci i zebrał gaz, który zwiększył jasność płomienia. Ponadto, gdy myszy zostały umieszczone w pojemniku z gazem, stały się bardziej aktywne. Priesley nazwał ten gaz pozbawiony zapłodnienia.
Priesley przekazał swoje obserwacje Antoine Lavoiserowi (1775), który powtórzył swoje eksperymenty pokazujące, że gaz został znaleziony w powietrzu i wodzie. Lavoiser uznał gaz za nowy pierwiastek, nazywając go tlenem.
Kiedy Lavoisier użył jako argumentu do sformułowania swojego prawa, że nadmierna masa obserwowana podczas spalania metali jest spowodowana czymś, co zostało wydobyte z powietrza, myślał o tlenie, pierwiastku, który łączy się z metalami podczas spalania..
Przykłady (ćwiczenia praktyczne)
Rozkład tlenku rtęci
Po ogrzaniu 232,6 tlenku rtęci (HgO) rozkłada się on na rtęć (Hg) i tlen cząsteczkowy (Odwa). Opierając się na zasadzie zachowania masy i mas atomowych: (Hg = 206,6 g / mol) i (O = 16 g / mol), podaj masy Hg i Odwa który jest tworzony.
HgO => Hg + Odwa
232,6 g 206,6 g 32 g
Obliczenia są bardzo proste, ponieważ rozkłada się dokładnie jeden mol HgO.
Spalanie pasa magnezowego

Wstęgę magnezu o wadze 1,2 g spalono w zamkniętym pojemniku zawierającym 4 g tlenu. Po reakcji pozostało 3,2 g nieprzereagowanego tlenu. Ile powstało tlenku magnezu?
Pierwszą rzeczą do obliczenia jest masa tlenu, który zareagował. Można to łatwo obliczyć, używając odejmowania:
Msza Odwa która zareagowała = masa początkowa Odwa - masa końcowa Odwa
(4 - 3,2) g Odwa
0,8 g Odwa
Na podstawie prawa zachowania masy można obliczyć masę powstałego MgO.
Masa MgO = masa Mg + masa O
1,2 g + 0,8 g
2,0 g MgO
Wodorotlenek wapnia
Masa 14 g tlenku wapnia (CaO) przereagowała z 3,6 g wody (HdwaO), który został całkowicie zużyty w reakcji, tworząc 14,8 g wodorotlenku wapnia, Ca (OH)dwa:
Ile tlenku wapnia przereagowało, tworząc wodorotlenek wapnia?
Ile zostało tlenku wapnia?
Reakcję można opisać następującym równaniem:
CaO + H.dwaO => Ca (OH)dwa
Równanie jest zrównoważone. Dlatego jest zgodny z prawem zachowania masy.
Masa CaO biorącego udział w reakcji = masa Ca (OH)dwa - masa H.dwaLUB
14,8 g - 3,6 g
11,2 g CaO
Dlatego CaO, który nie zareagował (ten, który został) jest obliczany poprzez odejmowanie:
Masa nadmiaru CaO = masa obecna w reakcji - masa, która wzięła udział w reakcji.
14 g CaO - 11,2 g CaO
2,8 g CaO
Tlenek miedzi
Ile tlenku miedzi (CuO) powstanie, gdy 11 g miedzi (Cu) zareaguje całkowicie z tlenem (Odwa)? Ile tlenu potrzeba w reakcji?
Pierwszym krokiem jest zbilansowanie równania. Zbilansowane równanie wygląda następująco:
2Cu + Odwa => 2CuO
Równanie jest zbilansowane, więc jest zgodne z prawem zachowania masy.
Masa atomowa Cu wynosi 63,5 g / mol, a masa cząsteczkowa CuO wynosi 79,5 g / mol..
Konieczne jest określenie, ile CuO powstaje w wyniku całkowitego utlenienia 11 g Cu:
Masa CuO = (11 g Cu) ∙ (1 mol Cu / 63,5 g Cu) ∙ (2 mole CuO / 2 mole Cu) ∙ (79,5 g CuO / mol CuO)
Masa utworzonego CuO = 13,77 g
Dlatego różnica mas między CuO i Cu daje ilość tlenu zaangażowanego w reakcję:
Masa tlenu = 13,77 g - 11 g
1,77 g Odwa
Tworzenie chlorku sodu
Masa chloru (Cldwa) 2,47 g poddano reakcji z wystarczającą ilością sodu (Na) i utworzyło się 3,82 g chlorku sodu (NaCl). Ile Na zareagowało?
Zrównoważone równanie:
2Na + Cldwa => 2NaCl
Zgodnie z prawem zachowania masy:
Masa Na = masa NaCl - masa Cldwa
3,82 g - 2,47 g
1,35 g Na
Bibliografia
- Flores, J. Química (2002). Od redakcji Santillana.
- Wikipedia. (2018). Prawo zachowania materii. Odzyskane z: es.wikipedia.org
- Narodowy Instytut Politechniczny. (s.f.). Prawo zachowania masy. CGFIE. Odzyskany z: aev.cgfie.ipn.mx
- Helmenstine, dr Anne Marie (18 stycznia 2019). Prawo zachowania masy. Pobrane z: thinkco.com
- Shrestha B. (18 listopada 2018). Prawo zachowania materii. Chemia LibreTexts. Źródło: chem.libretexts.org



Jeszcze bez komentarzy