
6 najważniejszych czynników wpływających na rozpuszczalność
Główny czynniki wpływające na rozpuszczalność Są to polaryzacja, efekt wspólnego jonu, temperatura, ciśnienie, charakter substancji rozpuszczonej i czynniki mechaniczne. Rozpuszczalność to zdolność substancji chemicznej w stanie stałym, ciekłym lub gazowym (zwanej substancją rozpuszczoną) do rozpuszczenia w rozpuszczalniku (zwykle cieczy) i utworzenia roztworu..
Rozpuszczalność substancji zależy głównie od zastosowanego rozpuszczalnika, a także od temperatury i ciśnienia. Rozpuszczalność substancji w określonym rozpuszczalniku mierzy się stężeniem nasyconego roztworu.

Roztwór uważa się za nasycony, gdy dodanie dodatkowej substancji rozpuszczonej nie zwiększa już stężenia roztworu..
Stopień rozpuszczalności różni się znacznie w zależności od substancji, od nieskończenie rozpuszczalnych (całkowicie mieszalnych), takich jak etanol w wodzie, do słabo rozpuszczalnych, takich jak chlorek srebra w wodzie. Termin „nierozpuszczalny” jest często stosowany do słabo rozpuszczalnych związków (Boundless, S.F.).
Niektóre substancje są rozpuszczalne we wszystkich proporcjach z danym rozpuszczalnikiem, na przykład etanol w wodzie, ta właściwość jest znana jako mieszalność.
W różnych warunkach równowagową rozpuszczalność można przekroczyć, uzyskując tak zwany roztwór przesycony (Solubility, S.F.).
Główne czynniki wpływające na rozpuszczalność
1- Biegunowość
W większości przypadków substancje rozpuszczone rozpuszczają się w rozpuszczalnikach o podobnej polarności. Chemicy używają popularnego aforyzmu do opisania tej cechy substancji rozpuszczonych i rozpuszczalników: „jak rozpuszcza się podobne”.
Niepolarne substancje rozpuszczone nie rozpuszczają się w polarnych rozpuszczalnikach i odwrotnie (Educating online, S.F.).
2- Wpływ jonu wspólnego
Efekt zwykłego jonu to termin, który opisuje spadek rozpuszczalności związku jonowego, gdy do mieszaniny dodaje się sól zawierającą jon, który już istnieje w równowadze chemicznej..
Efekt ten najlepiej tłumaczy zasada Le Châteliera. Wyobraź sobie, że słabo rozpuszczalny związek jonowy siarczanu wapnia, CaSO4, jest dodawany do wody. Równanie jonowe netto dla powstałej równowagi chemicznej jest następujące:
CaSO4 (s) ⇌Ca2 + (aq) + SO42− (aq)
Siarczan wapnia jest słabo rozpuszczalny. W stanie równowagi większość wapnia i siarczanu występuje w postaci stałej siarczanu wapnia..
Załóżmy, że rozpuszczalny związek jonowy siarczanu miedzi (CuSO4) został dodany do roztworu. Siarczan miedzi jest rozpuszczalny; Dlatego jego jedynym głównym wpływem na równanie jonowe netto jest dodanie większej ilości jonów siarczanowych (SO4dwa-).
CuSO4 (s) ⇌Cu2 + (aq) + SO42− (aq)
Jony siarczanowe dysocjowane od siarczanu miedzi są już obecne (wspólne dla) w mieszaninie w wyniku niewielkiej dysocjacji siarczanu wapnia.
Dlatego ten dodatek jonów siarczanowych podkreśla wcześniej ustaloną równowagę.
Zasada Le Chateliera mówi, że dodatkowe naprężenie po tej stronie produktu równowagi powoduje przesunięcie równowagi w kierunku strony reagentów, aby złagodzić ten nowy stres..
Ze względu na przesunięcie w stronę reagenta rozpuszczalność słabo rozpuszczalnego siarczanu wapnia jest dodatkowo zmniejszona (Erica Tran, 2016).
3- Temperatura
Temperatura ma bezpośredni wpływ na rozpuszczalność. W przypadku większości jonowych ciał stałych zwiększenie temperatury zwiększa szybkość przygotowania roztworu.
Wraz ze wzrostem temperatury cząsteczki ciała stałego poruszają się szybciej, co zwiększa prawdopodobieństwo, że będą oddziaływać z większą liczbą cząstek rozpuszczalnika. Powoduje to wzrost szybkości, z jaką wytwarzany jest roztwór..
Temperatura może również zwiększyć ilość substancji rozpuszczonej, którą można rozpuścić w rozpuszczalniku. Mówiąc ogólnie, wraz ze wzrostem temperatury rozpuszcza się więcej cząstek rozpuszczonych.
Na przykład dodanie cukru stołowego do wody jest łatwą metodą przygotowania roztworu. Po podgrzaniu tego roztworu i dodaniu cukru okazuje się, że można dodać duże ilości cukru w miarę wzrostu temperatury..
Powodem tego jest to, że wraz ze wzrostem temperatury siły międzycząsteczkowe mogą łatwiej pękać, umożliwiając przyciąganie większej liczby cząstek rozpuszczonych do cząstek rozpuszczalnika..
Istnieją jednak inne przykłady, w których wzrost temperatury ma bardzo niewielki wpływ na to, ile substancji rozpuszczonej można rozpuścić..
Dobrym przykładem jest sól kuchenna: w lodowatej wodzie można rozpuścić prawie taką samą ilość soli kuchennej, jak we wrzącej wodzie..
W przypadku wszystkich gazów wraz ze wzrostem temperatury rozpuszczalność maleje. Do wyjaśnienia tego zjawiska można wykorzystać kinetyczną teorię molekularną..
Wraz ze wzrostem temperatury cząsteczki gazu poruszają się szybciej i są w stanie uciec z cieczy. Zmniejsza się wówczas rozpuszczalność gazu.
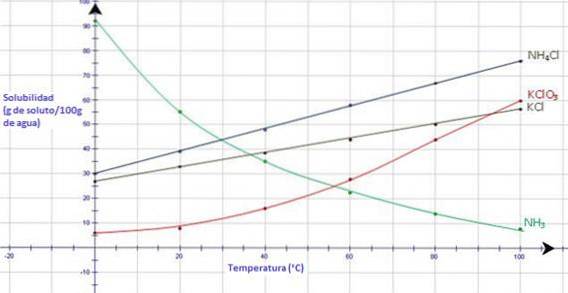
Patrząc na poniższy wykres, amoniak, NH3, wykazuje silny spadek rozpuszczalności wraz ze wzrostem temperatury, podczas gdy wszystkie jonowe ciała stałe wykazują wzrost rozpuszczalności wraz ze wzrostem temperatury (CK-12 Foundation, S.F.).
4- Ciśnienie
Drugi czynnik, ciśnienie, wpływa na rozpuszczalność gazu w cieczy, ale nigdy ciała stałego, które rozpuszcza się w cieczy..
Po przyłożeniu ciśnienia do gazu znajdującego się nad powierzchnią rozpuszczalnika, gaz przedostanie się do rozpuszczalnika i zajmie część przestrzeni między cząstkami rozpuszczalnika..
Dobrym przykładem jest soda gazowana. Stosuje się ciśnienie, aby wtłoczyć cząsteczki CO2 do sody. Jest też odwrotnie. Gdy ciśnienie gazu spada, zmniejsza się również rozpuszczalność tego gazu.
Po otwarciu puszki po napoju ciśnienie w sodzie spada, więc gaz natychmiast zaczyna wydostawać się z roztworu.
Dwutlenek węgla zmagazynowany w sodzie jest uwalniany i widać syczenie na powierzchni płynu. Jeśli zostawisz otwartą puszkę napoju gazowanego na jakiś czas, możesz zauważyć, że napój staje się płaski z powodu utraty dwutlenku węgla.
Ten współczynnik ciśnienia gazu jest wyrażony w prawie Henry'ego. Prawo Henry'ego mówi, że w danej temperaturze rozpuszczalność gazu w cieczy jest proporcjonalna do ciśnienia parcjalnego gazu nad cieczą.
Przykład prawa Henry'ego występuje w nurkowaniu. Kiedy dana osoba nurkuje w głębokiej wodzie, ciśnienie wzrasta i więcej gazów rozpuszcza się we krwi.
Wznosząc się z głębokiego nurkowania, nurek musi powrócić na powierzchnię wody z bardzo małą prędkością, aby wszystkie rozpuszczone gazy mogły bardzo powoli opuścić krew.
Jeśli osoba wynurza się zbyt szybko, może wystąpić nagły wypadek medyczny z powodu zbyt szybkiego opuszczania krwi przez gazy (Papapodcasts, 2010).
5- Charakter substancji rozpuszczonej
Charakter substancji rozpuszczonej i rozpuszczalnika oraz obecność innych związków chemicznych w roztworze wpływa na rozpuszczalność..
Na przykład w wodzie można rozpuścić więcej cukru niż soli w wodzie. W tym przypadku mówi się, że cukier jest bardziej rozpuszczalny.
Etanol w wodzie są całkowicie wzajemnie rozpuszczalne. W tym konkretnym przypadku rozpuszczalnikiem będzie związek znajdujący się w największej ilości.
Rozmiar substancji rozpuszczonej jest również ważnym czynnikiem. Im większe cząsteczki substancji rozpuszczonej, tym większa jest jej masa cząsteczkowa i rozmiar. Cząsteczkom rozpuszczalnika trudniej jest otoczyć większe cząsteczki.
Jeśli wykluczy się wszystkie wyżej wymienione czynniki, można przyjąć ogólną praktyczną zasadę, że większe cząstki są na ogół mniej rozpuszczalne..
Jeśli ciśnienie i temperatura są takie same jak między dwiema substancjami rozpuszczonymi o tej samej polarności, ta z mniejszymi cząstkami jest zwykle bardziej rozpuszczalna (czynniki wpływające na rozpuszczalność, S.F.).
6- czynniki mechaniczne
W przeciwieństwie do szybkości rozpuszczania, która zależy głównie od temperatury, szybkość rekrystalizacji zależy od stężenia substancji rozpuszczonej na powierzchni sieci krystalicznej, co jest korzystne, gdy roztwór jest nieruchomy.
Dlatego mieszanie roztworu zapobiega tej akumulacji, maksymalizując rozpuszczanie. (tipes of saturation, 2014).
Bibliografia
- (S.F.). Rozpuszczalność. Odzyskany z boundles.com.
- Fundacja CK-12. (S.F.). Czynniki wpływające na rozpuszczalność. Odzyskany z ck12.org.
- Edukacja online. (S.F.). Czynniki wpływające na rozpuszczalność. Odzyskany z solubilityofthings.com.
- Erica Tran, D.L. (28 listopada 2016). Rozpuszczalność i czynniki wpływające na rozpuszczalność. Odzyskany z chem.libretexts.org.
- Czynniki wpływające na rozpuszczalność. (S.F.). Odzyskany z sciencesource.pearsoncanada.ca.
- (2010, 1 marca). Czynniki wpływające na rozpuszczalność Część 4. Odzyskany z youtube.com.
- Rozpuszczalność. (S.F.). Odzyskany z chemed.chem.purdue.ed.
- końcówki nasycenia. (26 czerwca 2014). Odzyskany z chemii libretex.org.


Jeszcze bez komentarzy