
Charakterystyka Metarhizium anisopliae, taksonomia, morfologia
Metarhizium anisopliae jest mitosporycznym lub anamorficznym grzybem rozmnażania bezpłciowego, szeroko stosowanym jako entomopatogen do zwalczania biologicznego. Posiada zdolność pasożytowania i eliminowania szerokiej gamy szkodników owadzich różnych roślin o znaczeniu rolniczym..
Grzyb ten ma specjalne właściwości przystosowawcze, aby przeżyć w sposób saprofityczny na materii organicznej i jako pasożyt na owadach. Większość owadów będących szkodnikami upraw handlowych jest podatnych na atak tego entomopatogennego grzyba..

Jako organizm saprofityczny przystosowany jest do różnych środowisk, w których rozwija się grzybnia, konidiofory i konidia. Zdolność ta ułatwia jego reprodukcję na poziomie laboratoryjnym dzięki prostym technikom propagacji do wykorzystania jako biokontroler..
Rzeczywiście, ten entomopatogenny grzyb jest naturalnym wrogiem wielu gatunków owadów w różnych agroekosystemach. Żywiciele są całkowicie pokryte zieloną grzybnią, w odniesieniu do choroby zwanej zieloną muskardiną.
Cykl życia entomopatogenu Metarhizium anisopliae Odbywa się w dwóch fazach, w fazie infekcji komórkowej i drugiej fazie saprofitycznej. Zakaźny w owadzie zarażonym pasożytem i w saproficie wykorzystuje składniki odżywcze zwłok do rozmnażania.
W przeciwieństwie do patogenów, takich jak wirusy i bakterie, które muszą zostać połknięte przez patogen, aby działać, grzyb Metarhizium działa w kontakcie. W tym przypadku zarodniki mogą kiełkować i przenikać do wnętrza, infekując błonę naskórkową żywiciela..
Indeks artykułów
- 1 Funkcje
- 2 Morfologia
- 3 Taksonomia
- 4 Cykl życia
- 4.1 Muscardina zielona
- 5 Kontrola biologiczna
- 5.1 Sposób działania
- 6 Biologiczne zwalczanie szeliniaka bananowego
- 7 Biologiczna kontrola larw
- 7.1 Zmywanie przed upadkiem
- 7.2 Larwy białego robaka
- 8 Odniesienia
Charakterystyka
Plik Metarhizium anisopliae Jest to grzyb chorobotwórczy o szerokim spektrum, występujący w glebie i szczątkach pasożytujących owadów. Ze względu na swój potencjał jako ekologicznej alternatywy jest idealnym substytutem agrochemikaliów wykorzystywanych do integralnego zarządzania szkodnikami o znaczeniu gospodarczym..
Zakażenie M. anisopliae Rozpoczyna się połączeniem konidiów grzyba z naskórkiem owada żywiciela. Następnie, poprzez aktywność enzymatyczną między obiema strukturami i działanie mechaniczne, następuje kiełkowanie i penetracja..
Enzymy, które uczestniczą w rozpoznawaniu, adhezji i patogenezie naskórka żywiciela, znajdują się w ścianie komórkowej grzyba. Białka te obejmują fosfolipazy, proteazy, dysmutazy i adhezyny, które również uczestniczą w procesach adhezji, osmozy i morfogenezy grzyba..
Ogólnie rzecz biorąc, grzyby te działają wolno, gdy warunki środowiskowe są niekorzystne. Średnie temperatury od 24 do 28 ºC i wysoka wilgotność względna są idealne do skutecznego rozwoju i działania entomopatogennego.
Choroba zielonego muskardy spowodowana przez M. anisopliae charakteryzuje się zielonym zabarwieniem zarodników na skolonizowanym żywicielu. Po zaatakowaniu owada grzybnia pokrywa powierzchnię, gdzie struktury owocnikują i zarodnikują, pokrywając powierzchnię żywiciela..
W związku z tym infekcja trwa około tygodnia, zanim owad przestanie karmić i umrze. Spośród różnych szkodników, które zwalcza, jest wysoce skuteczny na owady z rzędu Coleoptera, Lepidoptera i Homoptera, zwłaszcza na larwy..
Grzyb M. anisopliae Jako biokontroler jest sprzedawany w postaci zarodników zmieszanych z obojętnymi materiałami, aby zachować jego żywotność. Odpowiednim sposobem jego zastosowania jest fumigacja, manipulowanie środowiskiem i zaszczepianie.
Morfologia
Na poziomie laboratoryjnym kolonie M. anisopliae wykazują skuteczny rozwój w pożywkach hodowlanych PDA (Papa-dextrorse-agar). Kolonia kolista przedstawia początkowo biały micelarny wzrost, wykazujący zmiany koloru, gdy grzyb zarodnikuje.
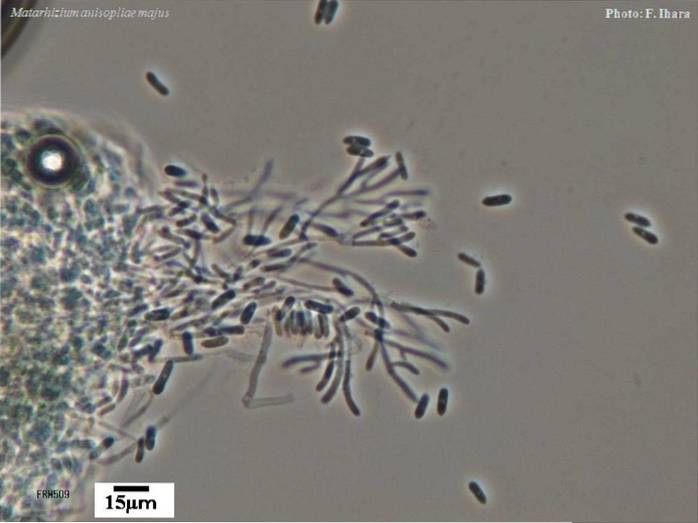
Kiedy zaczyna się proces namnażania konidiów, na powierzchni micelarnej dostrzega się oliwkowozielony kolor. Na spodniej stronie kapsułki obserwuje się bladożółte przebarwienie z rozproszonymi żółtymi pigmentami pośrodku.
Konidiofory wyrastają z grzybni w nieregularnym kształcie z dwoma do trzech gałęzi na każdej przegrodzie. Te konidiofory mają długość od 4 do 14 mikronów i średnicę od 1,5 do 2,5 mikrona..
Fialidy to struktury powstające w grzybni, będącej miejscem odrywania się konidiów. Na M. anisopliae są cienkie na wierzchołku, mają od 6 do 15 mikronów długości i od 2 do 5 mikronów średnicy.
Konidia to struktury jednokomórkowe, cylindryczne i ścięte, z długimi łańcuchami, od szklistej do zielonkawej. Konidia mają od 4 do 10 mikronów długości i od 2 do 4 mikronów średnicy.
Taksonomia
Płeć Metarhizium został początkowo opisany przez Sorokina (1883), zarażając larwy Austriacka Anisoplia, powodując chorobę znaną jako zielona muscardina. Nazwa Entomophthora anisopliae został pierwotnie zaproponowany przez Metschnikoffa dla izolatów grzybów, później został nazwany Niszczyciel Isaria.
Bardziej szczegółowe badania taksonomii rodzaju zakończone klasyfikacją jako Metarhizium sorokin. Obecnie rozważany jest gatunek M. anisopliae, nazwany przez Metschnikoffa, jako reprezentatywny organizm z rodzaju Metarhizium.
Różne izolaty grzyba Metarhizium są specyficzne, dlatego zostały uznane za nowe odmiany. Jednak obecnie są one klasyfikowane jako gatunki Metarhizium anisopliae, Metarhizium majus Y Metarhizium acridum.
Podobnie zmieniono nazwy niektórych gatunków, Metarhizium taii ma cechy podobne do Metarhizium guizhouense. Komercyjna odmiana M. anisopliae, the M. anisopliae (43) który jest teraz specyficznym wrogiem coleoptera Metarhizium brunneum.
Gatunki Metarhizium anisopliae (Metchnikoff) Sorokin (1883), należy do rodzaju Metarhizium opisane przez Sorokina (1883). Pod względem taksonomicznym należy do rodziny Clavicipitaceae, zamówienie Hypocreales, klasa Sordariomycetes, podział Ascomycota, królestwa Grzyby.
Koło życia
Grzyb Metarhizium anisopliae inicjuje patogenezę poprzez proces adhezji konidiów na błonie naskórka żywiciela. Następnie zachodzą fazy kiełkowania, wzrostu wyrostków lub struktur insercyjnych, kolonizacji i rozmnażania..
Zarodniki lub konidia z gleby lub skażone szczątki owadów atakują naskórek nowych żywicieli. Dzięki interwencji procesów mechanicznych i chemicznych rozwija się wyrostek robaczkowy i rurka zarodkowa, która przenika do wnętrza owada.
Generalnie w sprzyjających warunkach kiełkowanie następuje 12 godzin po zaszczepieniu. Podobnie, tworzenie się wyrostków robaczkowych i penetracja rurki zarodkowej lub haustorii zachodzi między 12 a 18 godzinami..
Fizycznym mechanizmem umożliwiającym penetrację jest nacisk wywierany przez wyrostki robaczkowe, które przerywają błonę naskórkową. Mechanizm chemiczny to działanie enzymów proteazy, kinazy i lipazy, które rozkładają błony w miejscu wprowadzenia.
Po przeniknięciu owada strzępki rozgałęziają się w środku, całkowicie atakując ofiarę po 3-4 dniach. Następnie powstają struktury rozrodcze, konidiofory i konidia, które kończą patogenezę żywiciela po 4-5 dniach.
Śmierć owada następuje w wyniku skażenia toksynami wytwarzanymi przez grzyba entomopatogennego. Biokontroler syntetyzuje toksyny dekstruksynę, protodekstruksynę i demetylodekstruksynę o wysokim poziomie toksyczności dla stawonogów i nicieni.
Inwazja żywiciela uwarunkowana jest temperaturą i wilgotnością względną otoczenia. Podobnie dostępność składników odżywczych na błonie śluzowej owada i zdolność wykrywania żywicieli podatnych na kolonizację..
Muscardina zielona
Choroba zielonego muskardy spowodowana przez Metarhizium anisopliae Przedstawia różne objawy na zakażonych larwach, nimfach lub osobnikach dorosłych. Niedojrzałe formy zmniejszają tworzenie się śluzu, mają tendencję do oddalania się od miejsca ataku lub paraliżują jego ruch.
Dorosłe osobniki ograniczają obszar ruchu i lotu, przestają karmić, a samice nie składają jaj. Zanieczyszczone owady mają tendencję do umierania w miejscach oddalonych od miejsca zakażenia, co sprzyja rozprzestrzenianiu się choroby.
Cykl chorobowy może trwać od 8 do 10 dni w zależności od warunków środowiskowych, głównie wilgotności i temperatury. Po śmierci żywiciela jest całkowicie pokryta białą grzybnią i kolejną zieloną sporulacją, charakterystyczną dla zielonej muskardy..
Kontrola biologiczna
Grzyb Metarhizium anisopliae jest to jeden z najczęściej badanych i stosowanych entomopatogenów w biologicznym zwalczaniu szkodników. Kluczowym czynnikiem dla pomyślnej kolonizacji żywiciela jest penetracja grzyba i późniejsze namnażanie..
Gdy grzyb osiedli się w owadzie, następuje namnażanie strzępek strzępkowych i wytwarzanie mykotoksyn, które inaktywują żywiciela. Śmierć żywiciela następuje również z powodu zmian patologicznych i mechanicznego wpływu na narządy wewnętrzne i tkanki..
Zwalczanie biologiczne polega na stosowaniu preparatów opartych na stężeniach zarodników lub konidiów grzyba w produktach handlowych. Konidia miesza się z materiałami obojętnymi, takimi jak rozpuszczalniki, gliny, talki, emulgatory i inne naturalne dodatki.
Materiały te nie mogą wpływać na żywotność grzyba i muszą być nieszkodliwe dla środowiska i upraw. Ponadto muszą one stanowić optymalne warunki fizyczne, które ułatwiają mieszanie, nakładanie produktu i są tanie..
Powodzenie zwalczania biologicznego przez entomopatogeny zależy od skutecznej formulacji produktu handlowego. W tym żywotność mikroorganizmu, materiał użyty w formulacji, warunki przechowywania i metoda aplikacji.
Tryb akcji
Inokulum z aplikacji preparatu z grzybem M. anisopliae Służy do zakażania larw, strzępek lub postaci dorosłych. Zanieczyszczeni żywiciele migrują w inne miejsca w uprawie, gdzie umierają i rozprzestrzeniają chorobę z powodu sporulacji grzyba.
Działanie wiatru, deszczu i rosy ułatwia rozprzestrzenianie się konidiów na inne części rośliny. Owady w swojej aktywności żerowej narażone są na przywieranie zarodników.
Warunki środowiskowe sprzyjają rozwojowi i rozprzestrzenianiu się konidiów, przy czym niedojrzałe stadia owadów są najbardziej podatne. Z nowych infekcji powstają ogniska wtórne, rozprzestrzeniające epizootię zdolną do pełnego zwalczania szkodnika.
Biologiczne zwalczanie wołka bananowego
Czarny wołek (Cosmopolites sordidus Germar) jest ważnym szkodnikiem uprawy musowatych (babki i banana), głównie w tropikach. Jego dyspersja jest spowodowana głównie zarządzaniem, jakie wykonuje człowiek w procesach siewu i zbioru..

Larwa jest przyczyną uszkodzenia kłącza. Wołkowiec w fazie larwalnej jest bardzo aktywny i żarłoczny, powodując perforacje wpływające na system korzeniowy rośliny..
Galerie utworzone w kłączu ułatwiają zakażenie mikroorganizmami gnijącymi tkanki naczyniowe rośliny. Oprócz tego roślina słabnie i ma tendencję do przewracania się z powodu działania silnych wiatrów..
Zwykłe zwalczanie opiera się na stosowaniu chemicznych środków owadobójczych, jednak ich negatywny wpływ na środowisko doprowadził do poszukiwania nowych alternatyw. Obecnie stosuje się grzyby entomopatogenne, takie jak Metarhizium anisopliae odnotowali dobre wyniki w próbach terenowych.
Doskonałe wyniki uzyskano w Brazylii i Ekwadorze (85-95% śmiertelności) przy użyciu M. anisopliae na ryżu jako materiale do zaszczepiania. Strategia polega na umieszczeniu zakażonego ryżu na kawałkach łodygi wokół rośliny, owad zostaje zwabiony i zakażony patogenem.
Biologiczna kontrola larw
Fall Armyworm
The Fall ArmywormSpodoptera frugiperda) jest jednym z najbardziej szkodliwych szkodników w zbożach, takich jak sorgo, kukurydza i pasze. W przypadku kukurydzy jest bardzo szkodliwy, gdy atakuje uprawy przed 30 dniem, przy wysokości od 40 do 60 cm..

Pod tym względem kontrola chemiczna pozwoliła owadowi uzyskać większą odporność, wyeliminować naturalnych wrogów i wyrządzić szkodę środowisku. Sposób użycia M. anisopliae jako alternatywa kontroli biologicznej od tamtej pory odnotowała dobre wyniki S. frugiperda jest podatny.
Najlepsze wyniki uzyskano stosując sterylizowany ryż jako sposób zdyspergowania inokulum w kulturze. Wykonywanie aplikacji o 10 dds, a następnie po 8 dniach, dostosowując recepturę na 1 × 1012 konidiów na hektar.
Larwy białego robaka
Larwy chrząszczy żywi się materią organiczną i korzeniami roślin uprawnych o znaczeniu ekonomicznym. Gatunki Hylamorpha elegans (Burmeister) zwany zielonym kurczakiem, jego stan larwalny jest szkodnikiem pszenicy (Triticum aestivum L.).

Uszkodzenia powodowane przez larwy pojawiają się na poziomie systemu korzeniowego, powodując osłabienie roślin, więdnięcie i utratę liści. Cykl życiowy chrząszcza trwa rok, aw okresie największego występowania obserwuje się całkowicie zniszczone obszary upraw.
Zwalczanie chemiczne było nieskuteczne z powodu migracji larw w traktowanych glebach. Związane ze zwiększoną odpornością, zwiększonymi kosztami produkcji i zanieczyszczeniem środowiska.
Zatrudnienie Metarhizium anisopliae Jako antagonista i środek biokontrolujący osiągnął nawet 50% śmiertelności w populacjach larw. Mimo że wyniki uzyskano na poziomie laboratoryjnym, oczekuje się, że analizy terenowe dadzą podobne wyniki..
Bibliografia
- Acuña Jiménez, M., García Gutiérrez, C., Rosas García, N. M., López Meyer, M., & Saínz Hernández, J. C. (2015). Sformułowanie Metarhizium anisopliae (Metschnikoff) Sorokin z biodegradowalnymi polimerami i jego zjadliwością wobec Heliothis virescens (Fabricius). International Journal of Environmental Pollution, 31 (3), 219–226.
- Arguedas, M., Álvarez, V., & Bonilla, R. (2008). Skuteczność entomopatogennego grzyba "Metharrizium anisopliae„Pod kontrolą”Boophilus microplus”(Acari: ixodidae). Costa Rican Agronomy: Journal of Agricultural Sciences, 32 (2), 137-147.
- Carballo, M. (2001). Opcje zarządzania wołkiem bananowym. Zintegrowana ochrona przed szkodnikami (Kostaryka) Nº, 59.
- Castillo Zeno Salvador (2005) Korzystanie z Metarhizium anisopliae do biologicznego zwalczania plwociny (Aeneolamia spp. Y Prosapia spp.) na użytkach zielonych Brachiaria dekumbens w El Petén, Gwatemala (praca magisterska) Źródło: catie.ac.cr
- Greenfield, B. P., Lord, A. M., Dudley, E. i Butt, T. M. (2014). Konidia grzyba patogennego owadów, Metarhizium anisopliae, nie przylegają do naskórka larw komara. Royal Society open science, 1 (2), 140193.
- González-Castillo, M., Aguilar, C. N., & Rodríguez-Herrera, R. (2012). Zwalczanie szkodników i owadów w rolnictwie przy użyciu grzybów entomopatogennych: wyzwania i perspektywy. Rev. naukowy Autonomous University of Coahuila, 4 (8).
- Lezama, R., Molina, J., López, M., Pescador, A., Galindo, E., Ángel, C. A. i Michel, A. C. (2005). Wpływ grzyba entomopatogennego Metarhizium anisopliae w sprawie kontroli upadku zbrojmistrza kukurydzy na polu. Postępy w badaniach rolnictwa, 9 (1).
- Rodríguez, M., France, A. i Gerding, M. (2004). Ocena dwóch szczepów grzyba Metarhizium Anisopliae var. Anisopliae (Metsh.) Do zwalczania larw białego robaka Hylamorpha elegans Burm. (Coleoptera: Scarabaeidae). Rolnictwo techniczne, 64 (1), 17–24.



Jeszcze bez komentarzy