
Moment dipolowy, jak jest obliczany i przykłady
Plik moment dipolowy jest właściwością chemiczną, która wskazuje, jak niejednorodnie rozmieszczone są ładunki elektryczne w cząsteczce. Wyrażana jest w jednostkach Debye'a, 3,33 · 10-30 C · m i generalnie jego wartości wahają się od 0 do 11 D.
Związki silnie polarne mają zwykle duże momenty dipolowe; a te niepolarne, małe momenty dipolowe. Im bardziej spolaryzowane są ładunki elektryczne w cząsteczce, tym większy jest jej moment dipolowy; to znaczy, musi istnieć region bogaty w elektrony δ- i inny ubogi w elektrony δ+.

Moment dipolowy μ jest wielkością wektorową, więc wpływają na niego kąty wiązań i ogólnie struktura molekularna.
Kiedy cząsteczka jest liniowa, można ją porównać do dwukolorowej gumki. Jej ujemny koniec δ- odpowiadałby kolorowi czerwonemu; podczas gdy dodatnia δ + byłaby kolorem niebieskim. Wraz ze wzrostem wielkości ładunków ujemnych na biegunie δ i odległości, która dzieli go od δ +, zwiększa się moment dipolowy.
Z chemicznego punktu widzenia oznacza to, że im większa różnica elektroujemności między dwoma atomami i im większa odległość, która je dzieli, tym większy moment dipolowy między nimi..
Indeks artykułów
- 1 Jak obliczany jest moment dipolowy?
- 2 Przykłady
- 2.1 Woda
- 2.2 Metanol
- 2.3 Amoniak
- 2.4 Etanol
- 2.5 Dwutlenek węgla
- 2,6 Metan
- 3 Odnośniki
Jak obliczyć moment dipolowy?
Uważa się, że wiązanie kowalencyjne między dwoma atomami, A i B:
A-B
Odległość między dodatnimi i ujemnymi ładunkami cząstkowymi jest już określona długością ich wiązania:
DOδ+-bδ-
Ponieważ protony i elektrony mają tę samą wielkość ładunku elektrycznego, ale z przeciwnymi znakami, 1,6 · 10-19C, to jest ten brany pod uwagę przy obliczaniu momentu dipolowego między A i B przy użyciu następującego równania:
μ = δre
Gdzie μ jest momentem dipolowym, δ jest ładunkiem elektronu bez znaku ujemnego, a re długość łącza wyrażona w metrach. Na przykład zakładając, że re ma wartość 2 Å (1 10-10m) moment dipolowy, μA-B wyniesie:
μA-B = (1,6 · 10-19C) · (2 · 10-10m)
= 3,210-29Cm
Ale ponieważ ta wartość jest bardzo mała, używana jest jednostka Debye:
μ = (3,210-29C · m) · (1 D / 3,33 · 10-30 Cm)
= 9,60 D.
Ta wartość μA-B może dać przypuszczenie, że wiązanie A-B jest bardziej jonowe niż kowalencyjne.
Przykłady
woda
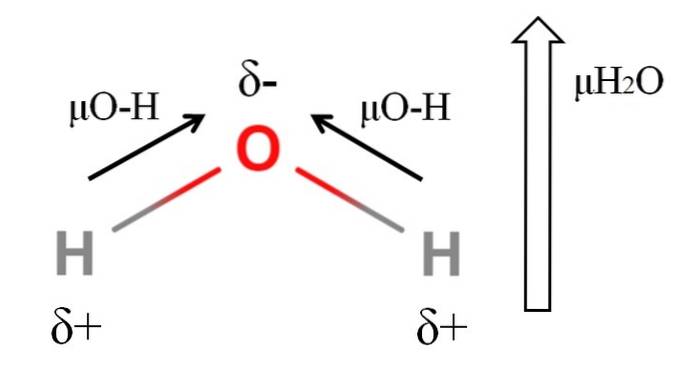
Aby obliczyć moment dipolowy cząsteczki, wszystkie momenty dipolowe ich odpowiednich wiązań muszą zostać dodane wektorowo, biorąc pod uwagę kąty wiązań i trochę trygonometrii. To na początku.
Woda ma jeden z największych momentów dipolowych, jakich można się spodziewać po związkach kowalencyjnych. Na górnym obrazie mamy, że atomy wodoru mają dodatnie ładunki cząstkowe, δ +, podczas gdy tlen ma ujemny ładunek cząstkowy, δ-. Wiązanie O-H jest dość polarne (1,5 D), aw cząsteczce H. są dwadwaLUB.
Zwykle rysowany jest wektor skierowany od atomu najmniej elektroujemnego (H) do atomu najbardziej elektroujemnego (O). Chociaż nie są one narysowane, na atomie tlenu znajdują się dwie pary niewspółdzielonych elektronów, które dodatkowo „koncentrują” obszar ujemny..
Ze względu na kątową geometrię H.dwaLub momenty dipolowe sumują się w kierunku atomu tlenu. Zauważ, że suma dwóch μO-H daje 3D (1,5 + 1,5); ale tak nie jest. Moment dipolowy wody ma eksperymentalną wartość 1,85D. Tutaj pokazano efekt kąta bliskiego 105º pomiędzy wiązaniami H-O-H..
Metanol
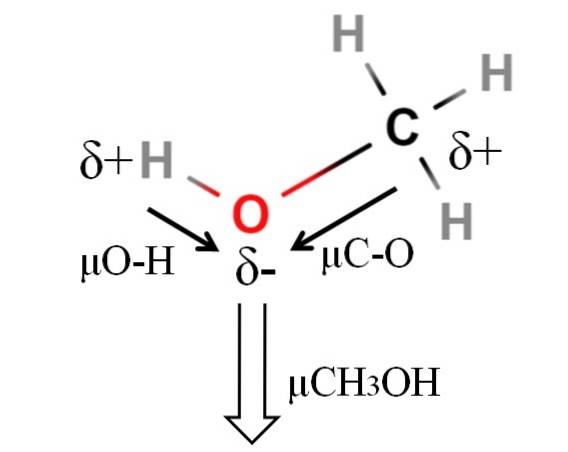
Moment dipolowy metanolu wynosi 1,69D. To mniej niż woda. Dlatego masy atomowe nie mają dużego wpływu na moment dipolowy; ale ich promienie atomowe są. W przypadku metanolu nie możemy stwierdzić, że jego wiązanie H-O ma μ równe 1,5 D; ponieważ środowiska molekularne są różne w CH3OH i H.dwaLUB.
Dlatego w celu obliczenia μO-H należałoby zmierzyć długość wiązania H-O w metanolu. Można powiedzieć, że μO-H jest większe niż μC-O, ponieważ różnica elektroujemności między węglem a tlenem jest mniejsza niż między wodorem a tlenem..
Metanol jest wymieniany jako jeden z najbardziej polarnych rozpuszczalników, które można znaleźć wraz z wodą i amoniakiem..
Amoniak
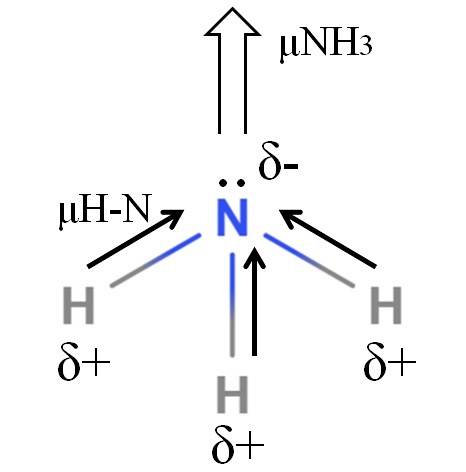
Wiązania H-N są dość polarne, więc azot ze względu na swoją wyższą elektroujemność przyciąga do siebie elektrony (górne zdjęcie). Oprócz tego mamy na nim niedzieloną parę elektronów, które przekazują swoje ujemne ładunki do regionu δ-. Dlatego na atomie azotu amoniaku przeważają ładunki elektryczne..
Amoniak ma moment dipolowy 1,42D, mniejszy niż metanol. Gdyby zarówno amoniak, jak i metanol można było przekształcić w przeciągi, można by zauważyć, że ciąg metanolu ma bardziej zdefiniowane bieguny w porównaniu z ciągiem amoniaku.
Etanol
W przypadku etanolu CH3CHdwaOH, jego moment dipolowy jest bardzo zbliżony do momentu metanolu, ale ma zwykle niższe wartości. Ponieważ jest więcej atomów węgla tworzących obszar δ +, atom tlenu reprezentujący δ- zaczyna tracić trochę swojej „względnej ujemnej intensywności”.
Dwutlenek węgla
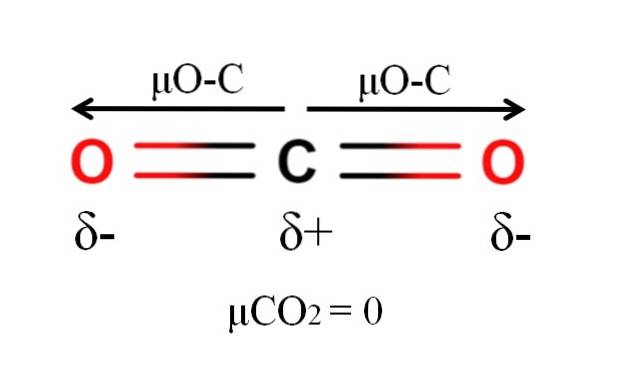
Dwutlenek węgla ma dwa wiązania polarne, C = O, z odpowiadającymi im momentami dipolowymi μO-C. Jednak, jak widać na powyższym obrazku, liniowa geometria COdwa powoduje, że dwa μO-C znoszą się wektorowo, nawet gdy węgiel ma dodatni ładunek częściowy, a tlen ma ujemny ładunek cząstkowy.
Z tego powodu dwutlenek węgla jest cząsteczką apolarną, ponieważ μCOdwa ma wartość 0D.
Metan
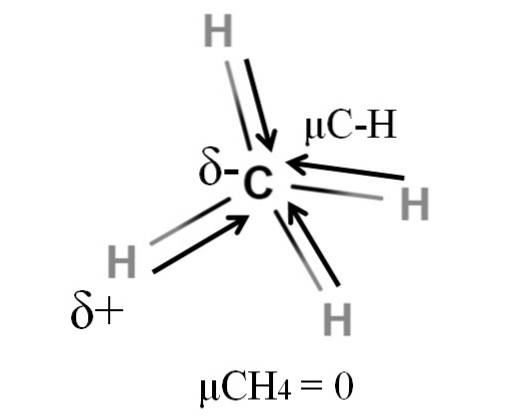
Zarówno metan, jak i dwutlenek węgla mają coś wspólnego: są to wysoce symetryczne cząsteczki. Ogólnie rzecz biorąc, im bardziej symetryczna jest cząsteczka, tym mniejszy jest jej moment dipolowy..
Jeśli zobaczymy cząsteczkę CH4, jego wiązania C-H są polarne, a elektrony są skierowane w stronę atomu węgla, ponieważ jest on nieco bardziej elektroujemny. Można by pomyśleć, że węgiel musiałby być wysoce ujemnym regionem δ; jak gumka z głębokim czerwonym środkiem i niebieskawymi końcami.
Jednak dzieląc CH4 na pół otrzymalibyśmy dwie połówki H-C-H, jedną po lewej, a drugą po prawej, podobne do cząsteczki HdwaO. Zatem moment dipolowy wynikający z dodania tych dwóch μC-H zrównałby się z momentem drugiej połowy. A zatem μCH4 ma wartość 0D.
Bibliografia
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning.
- Walter J. Moore. (1963). Chemia fizyczna. W kinetyce chemicznej. Wydanie czwarte, Longmans.
- Ira N. Levine. (2009). Zasady fizykochemii. Wydanie szóste, str. 479–540. Mc Graw Hill.
- Helmenstine, dr Anne Marie (29 stycznia 2020). Definicja momentu dipolowego. Odzyskany z: thinkco.com
- Blaber Mike. (29 września 2019). Dipole Moments. Chemia LibreTexts. Źródło: chem.libretexts.org
- LaRita Williams. (2020). Moment dipolowy: definicja, równanie i przykłady. Nauka. Odzyskany z: study.com
- Wikipedia. (2020). Moment dipolowy wiązania. Odzyskane z: en.wikipedia.org

Jeszcze bez komentarzy