
Struktura, właściwości i zastosowanie azotynu potasu (KNO2)

Plik azotyn potasu to sól nieorganiczna, której wzór chemiczny to KNOdwa, który jest chemicznie i farmakologicznie powiązany z azotanem potasu, KNO3. Jego wygląd fizyczny składa się z żółtawobiałych kryształów, silnie higroskopijnych, a zatem rozpływających się; to znaczy, szybko rozpuszczają się w wilgotnym środowisku.
Jego wzór wskazuje na udział jonów K.+ i niedwa- wynosi 1: 1 i są utrzymywane razem przez siły elektrostatyczne lub wiązania jonowe. Wydaje się, że nie znaleziono czystych naturalnych źródeł jego kryształów, chociaż aniony azotynowe można znaleźć w glebie, nawozach, roślinach i zwierzętach..

Powyższy obrazek pokazuje, jak wyglądają kryształy KNOdwa, z wyraźnymi żółtymi tonami. Jeśli te kryształy pozostaną w kontakcie z powietrzem, pochłoną wilgoć, aż staną się roztworem wodnym; rozwiązanie, które wywołało kontrowersje dotyczące tego, czy jego wykorzystanie do celów medycznych jest korzystne.
Z drugiej strony jego kryształy w bardzo małych ilościach (200 ppm) służą do solenia mięs i gwarantują ich konserwację przed działaniem bakterii. Podobnie KNOdwa poprawia kolor mięs, nadając im bardziej czerwonawy kolor; jednak podlega kilku ograniczeniom, aby uniknąć toksycznego wpływu tej soli na organizm.
Indeks artykułów
- 1 Struktura azotynu potasu
- 2 Właściwości
- 2.1 Masa cząsteczkowa
- 2.2 Gęstość
- 2.3 Temperatura topnienia
- 2.4 Temperatura wrzenia
- 2.5 Rozpuszczalność w wodzie
- 2.6 Rozpływ
- 2.7 Rozpuszczalność w innych rozpuszczalnikach
- 2,8 pH
- 3 Nazewnictwo
- 4 Otrzymywanie
- 5 zastosowań
- 5.1 Dodatek i odczynnik
- 5.2 Antidotum
- 5.3 Lekarze
- 6 Odnośniki
Struktura azotynu potasu
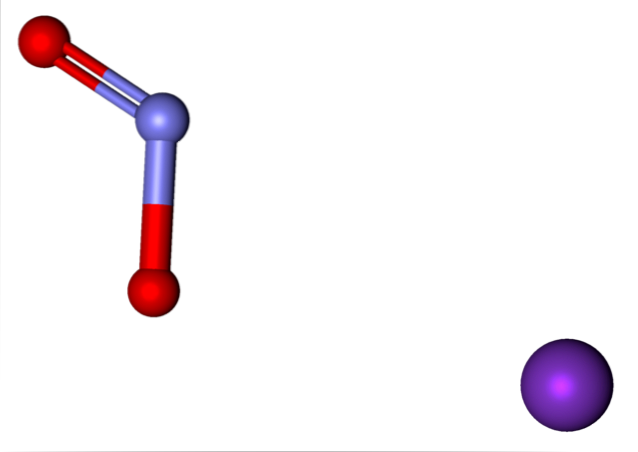
Jony obecne w azotynu potasu pokazano powyżej. Kation K.+ odpowiada fioletowej kuli, podczas gdy anion NOdwa- jest reprezentowana przez niebieskawe i czerwone kule.
Anion NIEdwa- pokazano z jednym wiązaniem podwójnym i jednym wiązaniem pojedynczym [O = N-O]-; ale w rzeczywistości oba wiązania są równym iloczynem rezonansu ujemnego ładunku między nimi.
Jony K.+ i niedwa- przyciągają się w przestrzeni, dopóki nie zorganizują strukturalnego wzoru z najmniejszą energią; to jest, gdy odpychanie między równymi ładunkami jest minimalne. I tak tworzą kryształy KNOdwa, którego komórka elementarna jest podatna na zmiany temperatury, które przemiany fazowe.
Na przykład w niskich temperaturach (poniżej 25 ° C) kryształy KNOdwa przyjąć system jednoskośny (faza I). Gdy temperatura przekroczy 25 ° C, następuje przejście fazowe od jednoskośnego do romboedrycznego (faza II). Wreszcie powyżej 40 ° C kryształy KNOdwa zmień na sześcienny (faza III).
Podobnie KNOdwa może wykazywać inne fazy krystaliczne (fazy IV, V i VI) pod wysokim ciśnieniem. Dzięki temu jony K.+ i niedwa- w końcu poruszają się i porządkują na różne sposoby w swoich czystych kryształach.
Nieruchomości
Masa cząsteczkowa
85,1038 g / mol.
Gęstość
1,9150 g / ml.
Temperatura topnienia
440,02 ° C (ale zaczyna się rozkładać od 350 ° C, wydzielając toksyczne opary).
Temperatura wrzenia
537 ° C (wybucha).
Rozpuszczalność w wodzie
312 g / 100 g wody o temperaturze 25 ° C.
Rozpływ
Jego rozpuszczalność w wodzie jest taka, że jest higroskopijny; tak bardzo, że wykazuje rozpływanie się, wchłaniając wystarczającą ilość wilgoci, aby się rozpuścić. To powinowactwo do wody może wynikać ze stabilności energetycznej, jaką zyskują jony K.+ po uwodnieniu, a także niską entalpię sieci krystalicznej dla kryształów KNOdwa.
Kryształy mogą wchłonąć wodę bez rozpuszczania, aby stać się hydratem, KNOdwaH.dwaO. W hydracie znajduje się cząsteczka wody towarzysząca jonom, co modyfikuje strukturę krystaliczną.
Ten hydrat (lub kilka z nich) może powstawać poniżej -9 ° C; w wyższych temperaturach woda rozpuszcza i uwadnia jony, deformując kryształ.
Rozpuszczalność w innych rozpuszczalnikach
Słabo rozpuszczalny w gorących alkoholach i bardzo dobrze rozpuszczalny w amoniaku.
pH
6-9. Jego wodne roztwory są zatem alkaliczne, ponieważ anion NOdwa- można hydrolizować.
Nomenklatura
Do KNOdwa można go również nazwać na inne sposoby. „Azotyn potasu” odpowiada nazwie tej soli zgodnie z nomenklaturą zapasów; „azotyn potasu” zgodnie z nomenklaturą systematyczną, w której wyróżnia się jedyną wartościowość potasu +1; oraz dioksonazotan (III) potasu, zgodnie z nomenklaturą systematyczną.
Nazwa „dioksonazotan (III) potasu” podkreśla wartość +3 atomu azotu. Chociaż jest to najbardziej zalecana nazwa przez IUPAC dla KNOdwa, „azotyn potasu” nadal jest najwygodniejszy i najłatwiejszy do zapamiętania.
Otrzymywanie
Najbardziej bezpośrednim sposobem jego syntezy, ale z mniejszą wydajnością, jest rozkład termiczny azotanu potasu lub saletry w temperaturze 400 ° C lub więcej:
2KNO3 => KNOdwa + LUBdwa
Jednak część KNOdwa Kończy się rozkładem pod wpływem ciepła, oprócz tworzenia się innych produktów.
Inną metodą przygotowania lub syntezy z wyższą wydajnością jest zmniejszenie KNO3 w obecności ołowiu, miedzi lub cynku. Równanie tej reakcji jest następujące:
KNO3 + Pb => KNOdwa + PbO
Azotan potasu i ołów miesza się stechiometrycznie na żelaznej patelni, gdzie topią się przy ciągłym mieszaniu i podgrzewaniu przez pół godziny. Tlenek ołowiu (II) ma kolor żółty, a powstałą masę sproszkowano na gorąco i potraktowano wrzącą wodą. Następnie gorącą mieszaninę filtruje się.
Gorący przesącz jest przepłukiwany dwutlenkiem węgla przez pięć minut, co spowoduje wytrącenie węglanu ołowiu, PbCO3, nierozpuszczalny. W ten sposób ołów jest oddzielany od przesączu. Do przesączu dodaje się rozcieńczony kwas azotowy do obojętnego pH, pozostawia do ostygnięcia, a na koniec odparowuje wodę, tak aby powstały kryształy KNO.dwa.
Aplikacje
Dodatek i odczynnik
Azotyn potasu jest stosowany jako dodatek do peklowania czerwonego mięsa, utrzymując jego smak i kolor na dłużej podczas przechowywania, jednocześnie opóźniając działanie bakterii i niektórych toksyn, np. Botuliny. Dlatego wykazuje działanie antybakteryjne.
KNOdwa utlenia się do NO, który reaguje z mioglobiną w mięsie iw konsekwencji zmienia swój naturalny czerwony kolor. Później, gdy mięso jest ugotowane, nabiera charakterystycznego, silnie różowego koloru.
Jednak pod warunkami bez określenia KNOdwa reaguje z białkami mięsa, tworząc nitrozoaminy, które mogą być rakotwórcze.
Z drugiej strony KNOdwa (chociaż najlepiej NaNOdwa) jest odczynnikiem analitycznym, który może być stosowany w syntezie barwników azowych (reakcja kwasu azotawego z aminami aromatycznymi) oraz w analizie aminokwasów.
Antidotum
Chociaż ma to swoje negatywne skutki, KNOdwa działa jako antidotum u pacjentów zatrutych cyjankami i siarkowodorem. Jego mechanizm polega na utlenieniu centrów Fedwa+ do wiary3+ z grup mamy hemoglobiny, produkujące methemoglobinę, która następnie reaguje z anionami CN- i HS-.
Lekarze
W soku żołądkowym z żołądka anion NOdwa- jest zredukowana do NO, o którym wiadomo, że ma działanie rozszerzające naczynia krwionośne, zwiększając przepływ krwi. W innych obszarach ciała, w których pH nie jest wystarczająco kwaśne, niektóre enzymy, takie jak oksydoreduktaza ksantyny, są odpowiedzialne za redukcję NOdwa-.
KNO został użytydwa w leczeniu dolegliwości i chorób, takich jak dławica piersiowa i padaczka (z bardzo negatywnymi skutkami ubocznymi).
Bibliografia
- Wikipedia. (2019). Azotyn potasu. Odzyskane z: en.wikipedia.org
- PrebChem. (2016). Przygotowanie azotynu potasu. Odzyskany z: prepchem.com
- Mark Gilchrist, Angela C. Shore, Nigel Benjamin. (2011). Nieorganiczny azotan i azotyn a kontrola ciśnienia krwi, Cardiovascular Research, tom 89, wydanie 3, 15 lutego 2011 r., Strony 492-498, doi.org/10.1093/cvr/cvq309
- PubChem. (2019). Azotyn potasu. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Formulacja chemiczna. (2018). Azotyn potasu. Odzyskany z: formulacionquimica.com
- Narodowe Centrum Postępu Nauk Translacyjnych. (2011). Azotyn potasu. Odzyskany z: drugs.ncats.io
- Richard J. Epley, Paul B. Addis i Joseph J. Warthesen. (1992). Azotyn w mięsie. Uniwersytet w Minnesocie.
- N. R. Rao, B. Prakash i M. Natarajan. (1975). Przemiany struktury krystalicznej w nieorganicznych azotynach, azotanach i węglanach. Wydział Chemii, Indyjski Instytut Technologii, Kanpur, Indie.

Jeszcze bez komentarzy