
Historia, właściwości, grupy, zastosowania niemetali
Plik bez metali Są to grupa pierwiastków, które znajdują się po prawej stronie układu okresowego, z wyjątkiem wodoru znajdującego się w grupie 1 (IA) wraz z metalami alkalicznymi. Jeśli chcesz wiedzieć, czym one są, musisz spojrzeć na prawy górny róg bloku p.
Atomy niemetalowe są stosunkowo małe, a ich zewnętrzna powłoka elektronowa zawiera dużą liczbę elektronów. Wśród pierwiastków niemetalicznych mogą być ciała stałe, ciecze i gazy; chociaż większość z nich jest w stanie gazowym, kilka z nich wzbogaca atmosferę.
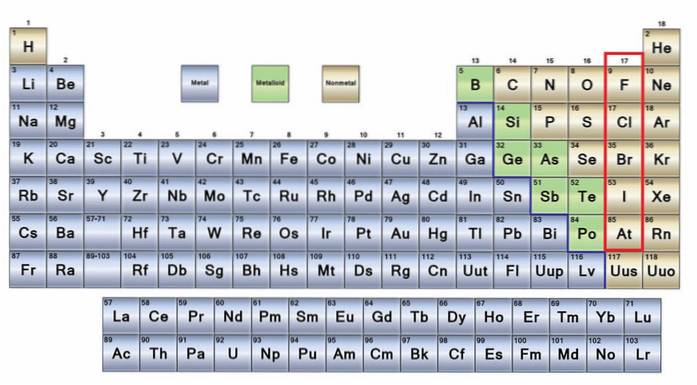
Znaczna część niemetali jest obecna we wszystkich żywych istotach w postaci związków i makrocząsteczek. Na przykład: węgiel, tlen i wodór są obecne we wszystkich białkach, lipidach, węglowodanach i kwasach nukleinowych.
Fosfor jest obecny we wszystkich kwasach nukleinowych oraz w niektórych węglowodanach i lipidach. Siarka znajduje się w wielu białkach. Azot jest częścią wszystkich kwasów nukleinowych i białek.
Z drugiej strony metan i ropa naftowa składają się prawie w całości z pierwiastków niemetalicznych. W rzeczywistości węglowodory (węgiel i wodór) dają wyobrażenie o tym, jak liczne są niemetale, pomimo mniejszej liczby pierwiastków w układzie okresowym..
Indeks artykułów
- 1 Historia
- 2 Właściwości fizyczne i chemiczne
- 2.1 Fizyka
- 2.2 Chemia
- 3 Grupy niemetali i pierwiastków
- 3.1 Grupa 1
- 3.2 Grupa 14
- 3.3 Grupa 15
- 3.4 Grupa 16
- 3.5 Grupa 17
- 3.6 Grupa 18
- 4 Zastosowania
- 4.1 Wodór
- 4.2 Węgiel
- 4.3 Azot
- 4.4 Fosfor
- 4.5 Tlen
- 4.6 Siarka
- 4.7 Selen
- 4.8 Fluor
- 4.9 Chlor
- 4.10 Brom
- 4.11 Jod
- 4.12 Hel
- 4.13 Neon
- 4.14 Argon
- 4.15 Xenon
- 4.16 Radon
- 5 Referencje
Fabuła
Od czasów starożytnych (3750 pne) Egipcjanie używali węgla do redukcji miedzi obecnej w ich minerałach, takich jak korwelit i malachit.
W 1669 roku Hennin Brandowi udało się wyizolować fosfor z zebranego moczu. Henry Cavendish (1776) zdołał zidentyfikować wodór, chociaż kilku badaczy, w tym Robert Boyle (1670), wytworzyło wodór w reakcji mocnego kwasu z metalem.
Carl Scheele wytwarzał tlen przez ogrzewanie tlenku rtęci azotanami (1771). Curtoisowi udało się wyodrębnić jod podczas próby przygotowania saletry z wodorostów (1811). Balard i Gmelin izolowany brom (1825).
W 1868 roku Janssen i Lockger niezależnie odkryli hel, obserwując żółtą linię w badaniu widma światła słonecznego, które nie należało do innego pierwiastka. Moissanowi udało się wyizolować fluor (1886).
W 1894 roku Lord Rayleigh i Ramsey odkryli argon, badając właściwości azotu. Ramsay i Travers (1898) wyizolowali krypton, neon i ksenon z ciekłego argonu przez kriogeniczną destylację powietrza..
Fizyczne i chemiczne właściwości

Fizyczny
Niektóre właściwości fizyczne niemetali to:
-Mają niską przewodność elektryczną, z wyjątkiem węgla w postaci grafitu, który jest dobrym przewodnikiem prądu elektrycznego..
-Mogą pojawić się pod fizycznym wyglądem ciał stałych, cieczy lub gazów.
-Mają niską przewodność cieplną, z wyjątkiem węgla w postaci diamentu, który nie zachowuje się jak izolator termiczny..
-Mają niski połysk, w przeciwieństwie do metalicznego połysku metali.
-Niemetalowe ciała stałe są kruche, więc nie są ciągliwe ani ciągliwe.
-Mają niską temperaturę topnienia i wrzenia.
-Mogą mieć różne struktury krystaliczne. Zatem fosfor, tlen i fluor mają sześcienną strukturę krystaliczną; wodór, węgiel i azot, heksagonalny; oraz siarka, chlor, brom i jod, rombowe.
Chemia
Niemetale charakteryzują się wysoką energią jonizacji i wysoką wartością elektroujemności. Na przykład fluor ma najwyższą elektroujemność (3,98), będąc najbardziej reaktywnym pierwiastkiem niemetali.
Ale co zaskakujące, najwyższą elektroujemność mają gazy szlachetne hel (5,5) i neon (4,84). Są jednak obojętne chemicznie, ponieważ zewnętrzne powłoki elektroniki są wypełnione..
Niemetale tworzą związki jonowe z metalami i kowalencyjne z niemetalami.
Stwierdzono, że pierwiastki niemetaliczne tworzą cząsteczki dwuatomowe, połączone wiązaniami kowalencyjnymi. Tymczasem atomy gazów szlachetnych mają postać jednostek atomowych.
Tworzą kwaśne tlenki, które w reakcji z wodą powodują powstawanie kwasów.
Grupy i elementy niemetalowe
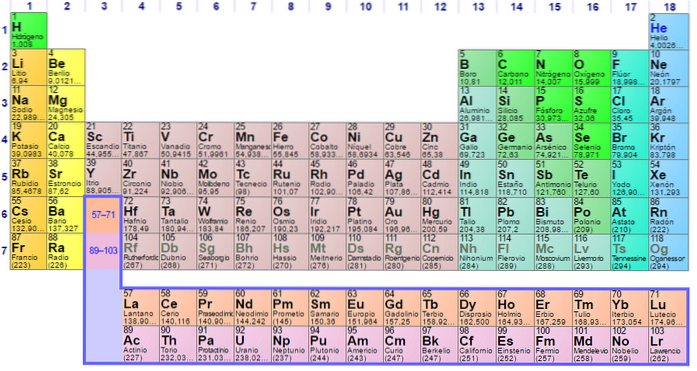
Grupa 1
Składa się z wodoru, bezbarwnego i bezwonnego gazu dwuatomowego. Stan utlenienia +1. Ma mniejszą gęstość niż powietrze. W stanie stałym ma heksagonalną strukturę krystaliczną. Wodór jest pierwiastkiem słabo reaktywnym.
Grupa 14
Węgiel jest jedynym niemetalem w tej grupie. Węgiel w postaci grafitu jest błyszczącym ciałem stałym o heksagonalnej strukturze krystalicznej. Posiada wysoką przewodność elektryczną. Jego najczęstsze stany utlenienia to +2 i +4.
Grupa 15
Azot
Bezbarwny i bezwonny gaz. Jest pierwiastkiem lekko reaktywnym i nieco gęstszym od powietrza. Najczęstsze stany utlenienia: -3 i +5. Tworzy cząsteczki dwuatomowe, Ndwa.
Mecz
Jednolity, jego kolor może być biały, żółty lub czarny. Mało reaktywny. Rombowa struktura kryształu. Elektroujemność 2.1. Najczęstsze stany utlenienia: -3 i +5.
Grupa 16
Tlen
Bezbarwny lub bladoniebieski gaz, bezwonny. Generalnie niereaktywny. Sześcienna struktura kryształu. Jest izolatorem i silnym utleniaczem. Elektroujemność 3.5. Stan utlenienia -2
Siarka
Jaskrawożółte ciało stałe, kruche, umiarkowanie reaktywne. Rombowa struktura kryształu. Tworzy wiązania kowalencyjne. Elektroujemność 2.5. Najczęstsze stany utlenienia: -2, +2, +4 i +6.
Selen
Jednolity szary lub czerwonawy do czarnego. Szary selen wykazuje wrażliwą na światło przewodność elektryczną. Jest to miękkie i kruche ciało stałe. Elektroujemność 2.4. Stany utlenienia: -2, +2, +4 i +6.
Grupa 17
Fluor
Jest to bladożółty gaz, bardzo toksyczny. Jest to bardzo reaktywny pierwiastek. Występuje jako cząsteczki dwuatomowe, F.dwa. W stanie stałym krystalizuje w postaci sześciennej. Elektroujemność 3,98. Stany utlenienia -1.
Chlor
Jest to zielono-żółty gaz. Przedstawia dwuatomowe cząsteczki Cldwa. Jest bardzo reaktywny. W stanie stałym struktura krystaliczna jest rombowa. Elektroujemność 3.0. Stany utlenienia: - 1, +1, +3, +5, +7.
Brom
Jest to czerwono-brązowa ciecz. Elektroujemność 2.8. Stany utlenienia -1, +1, +3, +5 i +7.
Jod
Jest to czarne ciało stałe, które po sublimacji wydziela fioletową parę. Rombowa struktura kryształu. Jodki metali są jonowe. Elektroujemność 2.5. Stany utlenienia: -1, +1, +3, +5 i +7.
Astatus
Jest to jednolita czerń. Centralna sześcienna struktura kryształu. Elektroujemność 2.2. Jest słabym utleniaczem.
Grupa 18
Hel
Posiada wysoką przewodność cieplną. Elektroujemność 5.5. Jest chemicznie obojętny i niepalny. Niska gęstość i wysoka płynność.
Neon
Wysoka wydajność chłodzenia w stanie ciekłym. Elektroujemność 4.84. Jest najmniej reaktywnym z gazów szlachetnych.
Argon
Jest gęstszy od powietrza. Chemicznie obojętny. Elektroujemność 3.2.
Krypton
Elektroujemność 2,94. Może reagować z fluorem, tworząc difluorek kryptonu (KrFdwa).
Ksenon
Przekracza barierę krew-mózg. Reaguje na prąd elektryczny, wytwarzając światło. Elektroujemność 2.2. Tworzy kompleksy z fluorem, złotem i tlenem.
Radon
To pierwiastek radioaktywny. Elektroujemność 2.06. Tworzy związki z fluorem (RnFdwa) i tlenem (RnO3).
Aplikacje
Wodór
Jest stosowany w napędzie rakietowym oraz jako paliwo w silnikach samochodowych wykorzystujących wodór. Wykorzystywany jest w syntezie amoniaku (NH3) oraz w uwodornianiu tłuszczów.
Węgiel

Grafit jest używany do produkcji ołówków i włókien o wysokiej wytrzymałości, które są używane do produkcji artykułów sportowych. Diament jest używany jako klejnot o dużej wartości, aw wywierconych otworach jako materiał ścierny. Dwutlenek węgla jest używany do produkcji napojów gazowanych.
Azot
Wykorzystywany jest do produkcji amoniaku, kwasu azotowego i mocznika. Azot jest niezbędnym pierwiastkiem dla roślin i jest używany do produkcji nawozów.
Mecz
Fosfor biały jest stosowany jako rodentycyd, insektycyd oraz w przemyśle pirotechnicznym. Do zapałek używa się czerwonego fosforu. Jej związki są również wykorzystywane do produkcji nawozów.
Tlen
Tlen jest używany do produkcji stali, tworzyw sztucznych i tekstyliów. Jest również stosowany w paliwach rakietowych, terapii tlenowej i wspomaganiu oddychania w samolotach, łodziach podwodnych i lotach kosmicznych..
Siarka
Wykorzystywany jest jako surowiec do produkcji kwasu siarkowego, prochu strzelniczego oraz do wulkanizacji kauczuków. Siarczyny są używane do wybielania papieru i fungicydów.
Selen
Służy do nadawania szkarłatnego czerwonego odcienia szkłu. Służy również do neutralizacji zielonkawego zabarwienia powstającego w wyniku zanieczyszczenia szkła związkami żelaza. Znajduje zastosowanie w fotokomórkach z zastosowaniem w drzwiach i windach.
Fluor

Dodawany jest do past do zębów, aby zapobiegać próchnicy. Jako surowiec do teflonu stosuje się fluorowodór. Monatomowy fluor jest używany do produkcji półprzewodników.
Chlor
Znajduje zastosowanie w metalurgii wydobywczej oraz w chlorowaniu węglowodorów do produkcji różnych produktów, takich jak PCW. Chlor jest używany w miazdze drzewnej i wybielaczach do tekstyliów. Jest również używany jako środek do dezynfekcji wody.
Brom
Służy do otrzymywania bromku srebra do soczewek światłoczułych i kliszy fotograficznej.Jest również używany do produkcji uspokajającego bromku sodu i dibrometanu, składnika przeciwstukowego benzyny.
Jod
Jodek potasu (KI) jest dodawany, aby zapobiec wole tarczycy. Nalewka z jodu jest używana jako środek antyseptyczny i bakteriobójczy. Jod jest częścią hormonów tarczycy.
Hel
Służy do napełniania balonów na ogrzane powietrze i miesza się z tlenem do oddychania głębinowego. Służy do spawania w atmosferze obojętnej, a także pomaga w utrzymaniu bardzo niskich temperatur w badaniach.
Neon
W szklanych tubach, które są oświetlane działaniem energii elektrycznej (czerwone neony).
Argon
Służy do tworzenia atmosfery do spawania i napełniania żarówek.
Ksenon
Mieszanka ksenonu i kryptonu jest używana do wytwarzania błysków o dużej intensywności przy krótkich naświetleniach fotograficznych.
Radon
Jest stosowany w leczeniu guzów nowotworowych metodą radioterapii.
Bibliografia
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning.
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Mathews, C. K., van Holde, K. E. and Ahern, K. G. (2002). Biochemia. Trzecia edycja. Edytować. Pearson-Addison Wesley
- Helmenstine, dr Anne Marie (06 października 2019). Jakie są właściwości niemetali? Odzyskany z: thinkco.com
- Wikipedia. (2019). Niemetal. Odzyskane z: en.wikipedia.org
- Redaktorzy Encyclopaedia Britannica. (5 kwietnia 2016). Niemetal. Encyclopædia Britannica. Odzyskany z: britannica.com
- José M. Gavira Vallejo. (27 stycznia 2016). Jakie są elementy poligeniczne? A icosagens, crystallógens, chalcogens ...? Odzyskany z: triplenlace.com


Jeszcze bez komentarzy