
Budowa, funkcje i przykłady nukleoprotein
ZA nukleoproteina Jest to każdy rodzaj białka, które jest strukturalnie związane z kwasem nukleinowym - albo RNA (kwas rybonukleinowy), albo DNA (kwas dezoksyrybonukleinowy). Najbardziej znanymi przykładami są rybosomy, nukleosomy i nukleokapsydy w wirusach..
Jednak żadne białko, które wiąże się z DNA, nie może być uznane za nukleoproteinę. Charakteryzują się one tworzeniem stabilnych kompleksów, a nie prostą przejściową asocjacją - jak białka, które pośredniczą w syntezie i degradacji DNA, które oddziałują chwilowo i krótko..
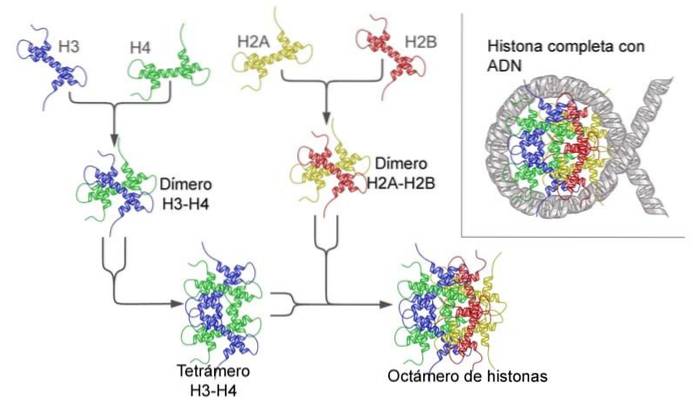
Funkcje nukleoprotein są bardzo zróżnicowane i zależą od badanej grupy. Na przykład główną funkcją histonów jest zagęszczanie DNA w nukleosomy, podczas gdy rybosomy uczestniczą w syntezie białek..
Indeks artykułów
- 1 Struktura
- 2 Charakter interakcji
- 3 Klasyfikacja i funkcje
- 3.1 Deoksyrybonukleoproteiny
- 3.2 Rybonukleoproteiny
- 4 Przykłady
- 4.1 Histony
- 4.2 Protaminy
- 4.3 Rybosomy
- 5 Referencje
Struktura
Generalnie nukleoproteiny składają się z dużego procentu reszt aminokwasowych zasadowych (lizyna, arginina i histydyna). Każda nukleoproteina ma swoją określoną strukturę, ale wszystkie zbiegają się, aby zawierać aminokwasy tego typu.
Przy fizjologicznym pH aminokwasy te są naładowane dodatnio, co sprzyja interakcji z cząsteczkami materiału genetycznego. Następnie zobaczymy, jak zachodzą te interakcje.
Charakter interakcji
Kwasy nukleinowe składają się ze szkieletu cukrów i fosforanów, które nadają im ładunek ujemny. Ten czynnik ma kluczowe znaczenie dla zrozumienia interakcji nukleoprotein z kwasami nukleinowymi. Wiązanie istniejące między białkami a materiałem genetycznym jest stabilizowane przez wiązania niekowalencyjne.
Podobnie, postępując zgodnie z podstawowymi zasadami elektrostatyki (prawo Coulomba), odkrywamy, że ładunki różnych znaków (+ i -) przyciągają.
Przyciąganie dodatnich i ujemnych ładunków białek i materiału genetycznego powoduje niespecyficzne interakcje. W przeciwieństwie do tego, specyficzne połączenia występują w określonych sekwencjach, takich jak rybosomalny RNA..
Istnieją różne czynniki, które mogą zmieniać interakcje między białkiem a materiałem genetycznym. Do najważniejszych należą stężenia soli, które zwiększają siłę jonową w roztworze; jonogenne środki powierzchniowo czynne i inne związki chemiczne o charakterze polarnym, takie jak między innymi fenol, formamid.
Klasyfikacja i funkcje
Nukleoproteiny są klasyfikowane według kwasu nukleinowego, do którego są przyłączone. W ten sposób możemy rozróżnić dwie dobrze zdefiniowane grupy: deoksyrybonukleoproteiny i rybonukleoproteiny. Logicznie rzecz biorąc, pierwszy docelowy DNA, a drugi RNA.
Deoksyrybonukleoproteiny
Najbardziej znaną funkcją dezoksyrybonukleoprotein jest zagęszczanie DNA. Komórka stoi przed wyzwaniem, które wydaje się prawie niemożliwe do pokonania: prawidłowe nawinięcie prawie dwóch metrów DNA w mikroskopijne jądro. Zjawisko to można osiągnąć dzięki istnieniu nukleoprotein, które organizują nić.
Grupa ta jest również związana z funkcjami regulacyjnymi m.in. w procesach replikacji, transkrypcji DNA, rekombinacji homologicznej..
Rybonukleoproteiny
Z kolei rybonukleoproteiny spełniają podstawowe funkcje, od replikacji DNA po regulację ekspresji genów i regulację centralnego metabolizmu RNA..
Są również związane z funkcjami ochronnymi, ponieważ informacyjny RNA nigdy nie jest wolny w komórce, ponieważ jest podatny na degradację. Aby tego uniknąć, szereg rybonukleoprotein łączy się z tą cząsteczką w kompleksach ochronnych..
Ten sam system występuje w wirusach, które chronią swoje cząsteczki RNA przed działaniem enzymów, które mogłyby je degradować.
Przykłady
Histony
Histony odpowiadają białkowemu składnikowi chromatyny. Są najbardziej widoczne w tej kategorii, chociaż znajdujemy również inne białka związane z DNA, które nie są histonami i należą do dużej grupy zwanej białkami niehistonicznymi.
Strukturalnie są najbardziej podstawowymi białkami chromatyny. A z punktu widzenia obfitości są proporcjonalne do ilości DNA.
Mamy pięć rodzajów histonów. Jego klasyfikacja była historycznie oparta na zawartości podstawowych aminokwasów. Klasy histonów są praktycznie niezmienne wśród grup eukariotycznych.
Tę ewolucyjną ochronę przypisuje się ogromnej roli, jaką odgrywają histony w istotach organicznych.
Jeśli sekwencja kodująca jakiekolwiek zmiany histonów będzie miała poważne konsekwencje dla organizmu, ponieważ jego opakowanie DNA będzie wadliwe. Zatem dobór naturalny jest odpowiedzialny za eliminację tych niefunkcjonalnych wariantów.
Spośród różnych grup najbardziej konserwatywne są histony H3 i H4. W rzeczywistości sekwencje są identyczne w organizmach tak odległych od siebie - mówiąc filogenetycznie - jak u krowy i grochu..
DNA zwija się w tak zwany oktamer histonu, a ta struktura jest nukleosomem - pierwszym stopniem zagęszczenia materiału genetycznego..
Protaminy
Protaminy to małe białka jądrowe (u ssaków składają się z polipeptydu o blisko 50 aminokwasach), charakteryzujące się dużą zawartością reszty aminokwasowej argininy. Główną rolą protamin jest zastępowanie histonów w haploidalnej fazie spermatogenezy.
Zaproponowano, że te typy podstawowych białek mają kluczowe znaczenie dla pakowania i stabilizacji DNA w męskiej gamecie. Różnią się od histonów tym, że pozwalają na gęstsze upakowanie.
U kręgowców znaleziono od 1 do 15 sekwencji kodujących białka, wszystkie zgrupowane na tym samym chromosomie. Porównanie sekwencji sugeruje, że wyewoluowały one z histonów. Najczęściej badane u ssaków to P1 i P2.
Rybosomy
Najbardziej rzucającym się w oczy przykładem białek, które wiążą się z RNA, są rybosomy. Są to struktury obecne w praktycznie wszystkich żywych organizmach - od małych bakterii po duże ssaki.
Główną funkcją rybosomów jest translacja wiadomości RNA na sekwencję aminokwasów.
Są wysoce złożoną maszynerią molekularną, składającą się z jednego lub więcej rybosomalnego RNA i zestawu białek. Możemy znaleźć je wolne w cytoplazmie komórki lub zakotwiczone w szorstkiej siateczce endoplazmatycznej (w rzeczywistości „szorstki” aspekt tego przedziału jest spowodowany rybosomami).
Istnieją różnice w wielkości i strukturze rybosomów między organizmami eukariotycznymi i prokariotycznymi..
Bibliografia
- Baker, T. A., Watson, J. D., Bell, S. P., Gann, A., Losick, M. A., & Levine, R. (2003). Biologia molekularna genu. Wydawnictwo Benjamin-Cummings.
- Balhorn, R. (2007). Rodzina protaminowych białek jądrowych plemników. Biologia genomu, 8(9), 227.
- Darnell, J. E., Lodish, H. F. i Baltimore, D. (1990). Biologia komórki molekularnej. Książki Scientific American.
- Jiménez García, L. F. (2003). Biologia komórkowa i molekularna. Pearson Education of Mexico.
- Lewin, B (2004). Geny VIII. Pearson Prentice Hall.
- Teijón, J. M. (2006). Podstawy biochemii strukturalnej. Od redakcji Tébar.


Jeszcze bez komentarzy