
Budowa chemiczna pentanonu, właściwości, synteza, zastosowania
Plik pentanon jest związkiem organicznym należącym do rodziny ketonów, którego wzór chemiczny to C5H.10O. To wciąż jeden z najprostszych ketonów i składa się z bezbarwnej cieczy o zapachu zbliżonym do acetonu. Od tego momentu ketony pod względem liczby atomów węgla w szkielecie wykazują izomeryzację pozycji.
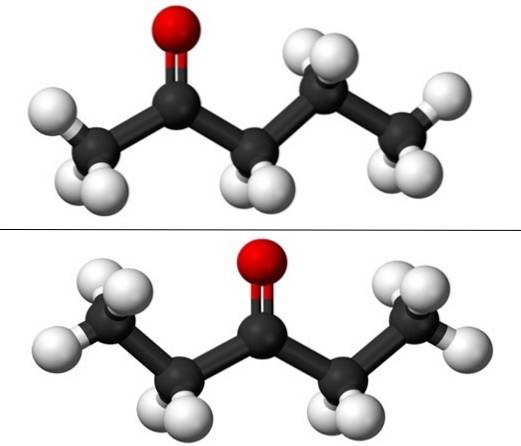
Mówiąc o izomerii pozycyjnej, odnosi się do miejsca, w którym znajduje się grupa karbonylowa, C = O. Zatem pentanon w rzeczywistości składa się z dwóch związków o właściwościach fizycznych, które nieznacznie się od siebie różnią: 2-pentanon i 3-pentanon (dolne zdjęcie). Oba są płynne, ale ich temperatury wrzenia są takie same, więc nie można ich rozdzielić przez destylację..
Jednak każdy z dwóch pentanonów ma swoją własną drogę syntezy, więc jest mało prawdopodobne, aby istniała ich mieszanina; mieszanka, którą można rozdzielić przez zamrożenie.
Ich zastosowania są szczególnie ograniczone jako rozpuszczalniki organiczne; alternatywy dla acetonu w środowiskach, w których jest on używany w temperaturze wyższej niż jego niska temperatura wrzenia. Podobnie są materiałami wyjściowymi do innych syntez organicznych, ponieważ ich grupa C = O może być zredukowana lub ulegać addycji nukleofilowej..
Indeks artykułów
- 1 Struktura chemiczna
- 1.1 Izomery pozycji
- 1.2 Oddziaływania międzycząsteczkowe
- 1.3 Kryształy
- 2 Właściwości
- 2.1 Wygląd fizyczny
- 2.2 Masa molowa
- 2.3 Gęstość
- 2.4 Temperatura topnienia
- 2.5 Temperatura wrzenia
- 2.6 Rozpuszczalność w wodzie
- 2.7 Prężność par
- 2.8 Temperatura zapłonu
- 2.9 Stabilność
- 3 Synteza
- 3.1 2-pentanon
- 3,2 3-pentanon
- 4 Zastosowania
- 5 Referencje
Struktura chemiczna
Izomery pozycji
Na obrazie mamy struktury molekularne dwóch izomerów pozycyjnych pentanonu, reprezentowane przez model sfer i słupków. Czarne kule odpowiadają szkieletom węglowym, białe - atomom wodoru, a czerwone - atomom tlenu z grupy C = O..
2-pentanon
2-pentanon (powyżej) ma grupę C = O w drugim atomie węgla, co jest równoważne tej, gdyby był w czwartym; czyli 2-pentanon i 4-pentanon są równoważne, ponieważ wystarczy obrócić je o 180º, aby ich struktura była taka sama.
Po lewej stronie C = O znajduje się rodnik metylowy, CH3-, a po jego prawej rodnik propylowy. Dlatego ten keton jest również nazywany (rzadziej stosowanym) ketonem metylowo-propylowym (MPK). Już na pierwszy rzut oka widać asymetrię tej konstrukcji.
3-pentanon
3-pentanon (na dole) ma grupę C = O na trzecim atomie węgla. Zauważ, że ten izomer jest większą wersją acetonu i że jest również bardzo symetryczny; dwa rodniki po bokach grupy C = O są takie same: dwa rodniki etylowe, CH3CHdwa-. Dlatego 3-pentanon jest również nazywany ketonem dietylowym (lub acetonem dimetylowym).
Oddziaływania międzycząsteczkowe
Obecność grupy karbonylowej, zarówno w 2-pentanonie, jak i 3-pentanonie, nadaje cząsteczce polarność.
Dlatego oba izomery pentanonu są zdolne do interakcji ze sobą poprzez siły dipol-dipol, w których najwyższa gęstość ładunku ujemnego, δ-, widoczna na mapie potencjału elektrostatycznego, będzie zorientowana wokół atomu tlenu..
Podobnie siły dyspersji londyńskiej interweniują w mniejszym stopniu między zwęglonymi i uwodornionymi szkieletami..
Ponieważ pentanon ma większą powierzchnię cząsteczkową i masę w porównaniu z acetonem, wkład ten zwiększa jego moment dipolowy i pozwala na uzyskanie wyższej temperatury wrzenia (102 ºC> 56 ºC). W rzeczywistości te dwa izomery odparowują w temperaturze 102 ° C; podczas zamrażania w różnych temperaturach.
Kryształy
Prawdopodobnie symetrie odgrywają ważną rolę w krystalizacji. Na przykład temperatura topnienia 2-pentanonu wynosi -78 ºC, a 3-pentanonu -39 ºC.
Oznacza to, że kryształy 3-pentanonu są bardziej odporne na temperaturę; jego cząsteczki są bardziej spójne i wymagają więcej ciepła do rozdzielenia się w fazie ciekłej.
Gdyby istniała mieszanina obu izomerów, 3-pentanon byłby pierwszym do krystalizacji, a 2-pentanon byłby ostatni w niższej temperaturze. Bardziej symetryczne cząsteczki 3-pentanonu orientują się łatwiej niż cząsteczki 2-pentanonu: asymetryczne i jednocześnie bardziej dynamiczne.
Nieruchomości
Wygląd fizyczny
Bezbarwne płyny o zapachu zbliżonym do acetonu.
Masa cząsteczkowa
86,13 g / mol
Gęstość
0,81 g / ml (3-pentanon)
0,809 g / ml (2-pentanon)
Temperatura topnienia
-78 ºC (2-pentanon)
-39 ºC (3-pentanon)
Temperatura wrzenia
102 ºC (dla obu izomerów)
Rozpuszczalność w wodzie
35 g / l (3-pentanon)
60 g / l (2-pentanon)
Ciśnienie pary
35 mmHg (3-pentanon)
270 mmHg (2-pentanon) w 20 ° C
Wartości te nie są przydatne do bezpośredniego porównywania ciśnień par obu izomerów, ponieważ pierwsza z nich jest podawana bez temperatury, w której została zmierzona..
Temperatura zapłonu
12,78 ° C (3-pentanon)
10 ºC (2-pentanon)
Stabilność
Dwa izomery pentanonu są skrajnie łatwopalne, dlatego należy je przechowywać jak najdalej od wszelkich źródeł ciepła. Punkty zapłonu wskazują, że płomień może zapalić opary obu pentanonów nawet przy temperaturze 10ºC..
Synteza
Chociaż dwa izomery pentanonu są fizycznie i chemicznie bardzo podobne, ich drogi syntezy są od siebie niezależne, więc jest mało prawdopodobne, aby oba zostały otrzymane w tej samej syntezie.
2-pentanon
Zaczynając od odczynnika 2-pentanolu, alkoholu drugorzędowego, można go utlenić do 2-pentanonu za pomocą kwasu podchlorawego utworzonego in situ, HClO, jako środka utleniającego. Utlenianie byłoby:
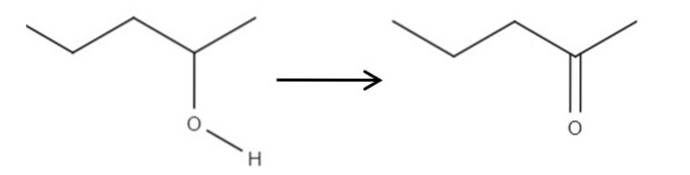
Po prostu wiązanie C-OH staje się C = O. Istnieją inne metody syntezy 2-pentanonu, ale z tego wszystkiego jest najłatwiejszy do zrozumienia..
3-pentanon
3-pentanon można zsyntetyzować przez ketonową dekarboksylację kwasu propanowego, CH3CHdwaCOOH. Ta droga syntezy prowadzi do powstania symetrycznych ketonów i składa się z cząsteczki CH3COOH straci grupę COOH jako COdwa, podczas gdy druga jego grupa OH w postaci H.dwaLUB:
2CH3CHdwaCOOH => CH3CHdwaSamochóddwaCH3 + WSPÓŁdwa + H.dwaLUB
Inną nieco bardziej złożoną drogą jest bezpośrednia reakcja mieszaniny etylenu, CHdwa= CHdwa, WSPÓŁdwa i Hdwa tworząc 3-pentanon.
Aplikacje
O ile aplikacja nie jest bardzo rygorystyczna, jest to specyficzna synteza lub też wykazano, że te dwa izomery nie dają takich samych wyników, nie ma znaczenia wybór między użyciem 2-pentanonu lub 3-pentanonu w którymkolwiek z ich zastosowań..
Innymi słowy, „nie ma znaczenia”, czy chcesz użyć 2-pentanonu czy 3-pentanonu jako rozpuszczalnika do farb lub żywic, czy też jako odtłuszczacza, gdyż najważniejszymi kryteriami będą jego cena i dostępność. 3-pentanon jest stosowany w przemyśle motoryzacyjnym do badania zachowania gazów w silnikach spalinowych.
Bibliografia
- Morrison, R. T. i Boyd, R, N. (1987). Chemia organiczna. Wydanie 5. Od redakcji Addison-Wesley Interamericana.
- Carey F. (2008). Chemia organiczna. (Wydanie szóste). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chemia organiczna. Aminy. (Wydanie 10.). Wiley plus.
- Wikipedia. (2019). 3-pentanon. Odzyskane z: en.wikipedia.org
- Narodowe Centrum Informacji Biotechnologicznej. (2019). 2-pentanon. Baza danych PubChem. CID = 7895. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Królewskie Towarzystwo Chemii. (2019). 3-pentanon. Źródło: chemspider.com
- Profesor T. Nalli. (2013). Utlenianie 2-pentanolu i destylacja produktu. Odzyskany z: course1.winona.edu



Jeszcze bez komentarzy