
Struktura, właściwości i zastosowanie nadtlenku baru (BaO2)

Plik nadtlenek baru jest związkiem jonowym i nieorganicznym o wzorze chemicznym BaOdwa. Będąc związkiem jonowym, składa się z jonów Badwa+ mniedwadwa-; ten ostatni jest tak zwanym anionem nadtlenkowym, a z tego powodu BaOdwa zyskuje swoją nazwę. W tym przypadku BaOdwa jest nieorganicznym nadtlenkiem.
Ładunki jego jonów ujawniają, w jaki sposób ten związek powstaje z pierwiastków. Metal baru z grupy 2 daje dwa elektrony cząsteczce tlenu, Odwa, których atomy nie są wykorzystywane do redukcji się do anionów tlenkowych, LUBdwa-, ale być trzymanym razem przez proste łącze, [O-O]dwa-.

Nadtlenek baru jest w temperaturze pokojowej ziarnistą substancją stałą o barwie białej z lekko szarawymi odcieniami (górne zdjęcie). Podobnie jak prawie wszystkie nadtlenki, należy obchodzić się z nim i przechowywać ostrożnie, ponieważ może przyspieszyć utlenianie niektórych substancji.
Spośród wszystkich nadtlenków utworzonych przez metale grupy 2 (Mr. Becambara), BaOdwa jest termodynamicznie najbardziej stabilny wobec rozkładu termicznego. Po podgrzaniu uwalnia tlen i wytwarza się tlenek baru BaO. BaO może reagować z tlenem w środowisku pod wysokim ciśnieniem, tworząc ponownie BaOdwa.
Indeks artykułów
- 1 Struktura
- 1.1 Energia sieci krystalicznej
- 1.2 Nawilża
- 2 Przygotowanie lub synteza
- 3 Właściwości
- 3.1 Wygląd fizyczny
- 3.2 Masa cząsteczkowa
- 3.3 Gęstość
- 3.4 Temperatura topnienia
- 3.5 Temperatura wrzenia
- 3.6 Rozpuszczalność w wodzie
- 3.7 Rozkład termiczny
- 4 Nazewnictwo
- 5 zastosowań
- 5.1 Producent tlenu
- 5.2 Producent nadtlenku wodoru
- 6 Odnośniki
Struktura
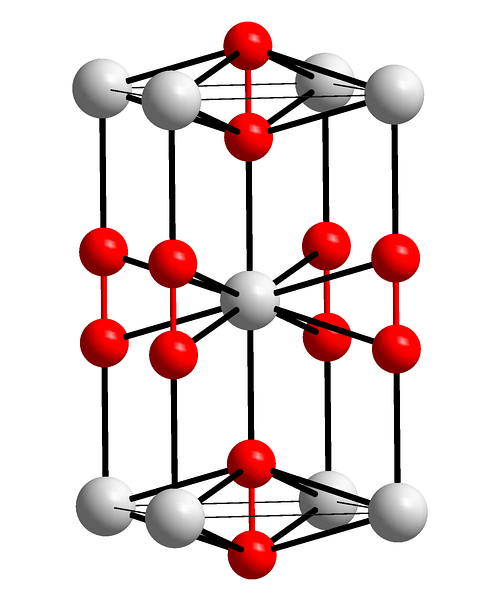
Górny obraz przedstawia tetragonalną komórkę elementarną nadtlenku baru. Wewnątrz widać kationy Badwa+ (białe kule) i aniony Odwadwa- (czerwone kule). Zauważ, że czerwone kule są połączone pojedynczym wiązaniem, więc reprezentują geometrię liniową [O-O]dwa-.
Z tej komórki elementarnej można budować kryształy BaOdwa. Jeśli zostanie zaobserwowany, anion Odwadwa- widać, że jest otoczony przez sześć Badwa+, uzyskanie ośmiościanu, którego wierzchołki są białe.
Z drugiej strony, jeszcze bardziej widoczne, każdy Badwa+ jest otoczony przez dziesięć Odwadwa- (biała kula w środku). Cały kryształ składa się z tej stałej kolejności krótkiego i dalekiego zasięgu.
Energia sieci krystalicznej
Jeśli zaobserwuje się również czerwono-białe kulki, należy zauważyć, że nie różnią się one zbytnio rozmiarami ani promieniami jonowymi. To dlatego, że Ba kationdwa+ jest bardzo nieporęczny, a jego interakcje z anionem Odwadwa- stabilizują energię sieci krystalicznej w lepszym stopniu niż np. kationy Ca.dwa+ i Mgdwa+.
To wyjaśnia również, dlaczego BaO jest najbardziej niestabilnym z tlenków metali ziem alkalicznych: jony Ba.dwa+ mniedwa- różnią się znacznie rozmiarami, destabilizując ich kryształy.
Ponieważ jest bardziej niestabilny, niższy jest trend BaOdwa rozkładanie do postaci BaO; w przeciwieństwie do nadtlenków SrOdwa, CaOdwa i MgOdwa, których tlenki są bardziej stabilne.
Nawilża
BaOdwa można znaleźć w postaci hydratów, w tym BaOdwa∙ 8HdwaAlbo jest najbardziej stabilny ze wszystkich; iw rzeczywistości to jest ten, który jest sprzedawany zamiast bezwodnego nadtlenku baru. Aby otrzymać bezwodny BaO należy suszyć w temperaturze 350 ° Cdwa∙ 8HdwaLub w celu usunięcia wody.
Jego struktura krystaliczna jest również tetragonalna, ale zawiera osiem cząsteczek H.dwaO interakcji z Odwadwa- poprzez wiązania wodorowe i Badwa+ przez interakcje dipol-jon.
Inne hydraty, o których budowie nie ma wielu informacji w tym zakresie to: BaOdwa∙ 10HdwaO, BaOdwa∙ 7HdwaO i BaOdwa∙ H.dwaLUB.
Przygotowanie lub synteza
Bezpośrednie przygotowanie nadtlenku baru polega na utlenieniu jego tlenku. Można go użyć z mineralnego barytu lub z soli azotanu baru Ba (NO3)dwa; obie są ogrzewane w atmosferze wzbogaconej powietrzem lub tlenem.
Inna metoda polega na przereagowaniu Ba (NIE3)dwa z nadtlenkiem sodu:
Kąpiel3)dwa + NadwaLUBdwa + xHdwaO => BaOdwa∙ xHdwaO + 2NaNO3
Następnie uwodniony BaOdwa∙ xHdwaLub jest poddawany ogrzewaniu, filtrowaniu i wykańczaniu przez suszenie pod próżnią.
Nieruchomości
Wygląd fizyczny
Jest to biała substancja stała, która może zmienić kolor na szarą, jeśli zawiera zanieczyszczenia (BaO, Ba (OH)dwa, lub inne związki chemiczne). Jeśli zostanie podgrzany do bardzo wysokiej temperatury, będzie wydzielał zielonkawe płomienie z powodu przejść elektronicznych kationów Ba.dwa+.
Masa cząsteczkowa
169,33 g / mol.
Gęstość
5,68 g / ml.
Temperatura topnienia
450 ° C.
Temperatura wrzenia
800 ° C. Ta wartość jest zgodna z tym, czego należy oczekiwać od związku jonowego; a nawet więcej, najbardziej stabilnego nadtlenku metali ziem alkalicznych. Jednak BaO tak naprawdę nie wrzedwa, raczej gazowy tlen jest uwalniany w wyniku jego rozkładu termicznego.
Rozpuszczalność w wodzie
Nierozpuszczalny. Jednak może powoli ulegać hydrolizie, aby wytworzyć nadtlenek wodoru, H.dwaLUBdwa; a ponadto, jego rozpuszczalność w środowisku wodnym wzrasta, jeśli doda się rozcieńczony kwas.
Rozkład termiczny
Poniższe równanie chemiczne przedstawia reakcję rozkładu termicznego, której podlega BaOdwa:
2BaOdwa <=> 2BaO + Odwa
Reakcja jest jednokierunkowa, jeśli temperatura przekracza 800 ° C. Jeśli ciśnienie zostanie natychmiast zwiększone, a temperatura spadnie, cały BaO zostanie przekształcony z powrotem w BaOdwa.
Nomenklatura
Inny sposób na nazwanie BaOdwa zgodnie z tradycyjną nomenklaturą jest to nadtlenek baru; ponieważ bar może mieć tylko wartościowość +2 w swoich związkach.
Błędnie, systematyczna nomenklatura jest używana do określania go jako dwutlenku baru (binoksydu), uznając go za tlenek, a nie nadtlenek.
Aplikacje
Producent tlenu
Za pomocą mineralnego barytu (BaO) ogrzewa się go prądami powietrza w celu wyeliminowania zawartości tlenu w temperaturze około 700 ° C..
Jeśli powstały nadtlenek zostanie delikatnie podgrzany pod próżnią, tlen jest regenerowany szybciej, a baryt może być ponownie użyty w nieskończoność do magazynowania i produkcji tlenu..
Ten proces został komercyjnie opracowany przez L. D. Brina, obecnie przestarzały.
Producent nadtlenku wodoru
Nadtlenek baru reaguje z kwasem siarkowym, tworząc nadtlenek wodoru:
Belkadwa + H.dwapołudniowy zachód4 => H.dwaLUBdwa + Baso4
Dlatego jest źródłem H.dwaLUBdwa, zmanipulowany szczególnie z jego hydratem BaOdwa∙ 8HdwaLUB.
Zgodnie z tymi dwoma wymienionymi zastosowaniami BaOdwa pozwala na rozwój Odwa i HdwaLUBdwa, zarówno utleniacze, w syntezie organicznej, jak iw procesach bielenia w przemyśle tekstylnym i farbiarskim. Jest również dobrym środkiem dezynfekującym..
Ponadto od BaOdwa można syntetyzować inne nadtlenki, takie jak sód, NadwaLUBdwa, i inne sole baru.
Bibliografia
- S.C. Abrahams, J. Kalnajs. (1954). Struktura krystaliczna nadtlenku baru. Laboratorium Badań nad Izolacją, Massachusetts Institute of Technology, Cambridge, Massachusetts, USA.
- Wikipedia. (2018). Nadtlenek baru. Odzyskane z: en.wikipedia.org
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Atomistyka. (2012). Nadtlenek baru. Odzyskany z: barium.atomistry.com
- Khokhar i in. (2011). Badanie przygotowania skali laboratoryjnej i opracowania procesu dla nadtlenku baru. Odzyskany z: academia.edu
- PubChem. (2019). Nadtlenek baru. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- PrebChem. (2016). Przygotowanie nadtlenku baru. Odzyskany z: prepchem.com


Jeszcze bez komentarzy