
Struktura, właściwości, zastosowanie nadtlenku sodu (Na2O2)

Plik nadtlenek sodu jest związkiem chemicznym o wzorze NadwaLUBdwa Ma dwa wiązania jonowe między dwoma atomami sodu i cząsteczką O2. Występuje w różnych hydratach i peroksyhydratach, w tym NadwaLUBdwa 2HdwaLUBdwa 4HdwaNadwaLUBdwa 2HdwaNadwaLUBdwa 2HdwaLUBdwa i NadwaLUBdwa 8HdwaLUB.
Ma heksagonalną strukturę krystaliczną, jednak po podgrzaniu forma ta przechodzi w fazę o nieznanej symetrii w temperaturze 512 ° C. Jej strukturę krystaliczną przedstawiono na rysunku 2 (Sód: nadtlenek sodu, 1993-2016).
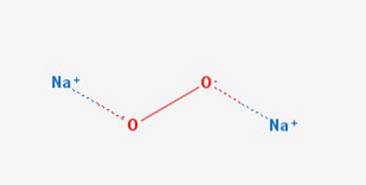

Nadtlenek sodu można otrzymać na dużą skalę w reakcji metalicznego sodu z tlenem w temperaturze 130-200 ° C (Ashford, 1994), w procesie, w którym powstaje tlenek sodu, który w oddzielnym etapie pochłania tlen:
4 Na + Odwa → NadwaLUB
2 NadwaO + Odwa → 2 NadwaLUBdwa
Obecny proces okresowy obejmuje utlenianie sodu w monotlenku sodu za pomocą suchego powietrza, a następnie utlenianie monotlenku w nadtlenku z 90% tlenem..
W 1951 roku USI uruchomiło pierwszy ciągły proces produkcji nadtlenku sodu. Proces jest wyjątkowy pod jednym względem: wykorzystuje powietrze zamiast czystego tlenu.
Od prawie 70 lat stosowane są różne odmiany procesu okresowego (SCHOW, 1957), na przykład produkt handlowy zawiera od 90 do 95% nadtlenku wodoru.
Indeks artykułów
- 1 Właściwości fizyczne i chemiczne nadtlenku sodu
- 2 Reaktywność i zagrożenia
- 3 Zastosowania
- 4 Odnośniki
Właściwości fizyczne i chemiczne nadtlenku sodu
Nadtlenek sodu to żółtawe ziarniste ciało stałe, które zmienia kolor na żółty w kontakcie z atmosferą (National Center for Biotechnology Information, S.F.). Ich wygląd ilustruje rysunek 3.

Nadtlenek sodu ma masę cząsteczkową 77,98 g / mol i gęstość 2,805 g / ml. Związek ma temperaturę topnienia 460,00 ° C, w którym zaczyna się rozkładać na tlenek sodu i tlen cząsteczkowy zgodnie z reakcją:
2 Na2O2 → 2 Na2O + O2
Jego temperatura wrzenia wynosi 657 ° C (Royal Society of Chemistry, 2015).
Nadtlenek sodu gwałtownie reaguje z czynnikami redukującymi, materiałami palnymi i metalami lekkimi. Reaguje egzotermicznie i szybko lub nawet wybuchowo z wodą, tworząc silną zasadę (NaOH) i tlen (O2).
Mieszanina z nadsiarczanem amonu może eksplodować, jeśli zostanie poddana tarciu (mieleniu w moździerzu), jeśli zostanie podgrzana lub jeśli przepłynie nad nią strumień gazowego dwutlenku węgla..
Reaguje bardzo energicznie z gazowym siarkowodorem. Nawet przy braku powietrza reakcji może towarzyszyć płomień. Wybuch następuje, gdy gazowy dwutlenek węgla przechodzi przez mieszaninę nadtlenku sodu i proszku magnezu..
Mieszaniny z kwasem octowym lub bezwodnikiem octowym mogą wybuchnąć, jeśli nie są przechowywane w niskiej temperaturze. Są samorzutnie zapalne w kontakcie z aniliną, benzenem, eterem dietylowym lub materiałami organicznymi, takimi jak papier i drewno..
Miesza się z węglem drzewnym, gliceryną, niektórymi olejami i fosforem, pali się lub eksploduje. Mieszanina z węglikiem wapnia (proszek) może zapalić się pod wpływem wilgotnego powietrza i eksplodować po podgrzaniu.
Rozkłada się, często gwałtownie w obecności katalitycznych ilości dwutlenku manganu. Mieszanina z monochlorkiem siarki prowadzi do gwałtownej reakcji. Może reagować i powodować zapłon paliw (NADTLENEK SODU, 2016).
Reaktywność i zagrożenia
Nadtlenek sodu jest związkiem klasyfikowanym jako silna zasada, wybuchowy i silny środek utleniający na podstawie alarmu reaktywności. Mieszaniny z materiałem palnym łatwo ulegają zapaleniu w wyniku tarcia, ciepła lub kontaktu z wilgocią.
Może gwałtownie rozkładać się pod wpływem długotrwałego działania ciepła, powodując pękanie pojemników z nim zawartych.
Bardzo niebezpieczny w przypadku kontaktu ze skórą i oczami (działanie drażniące) oraz w przypadku spożycia i wdychania. Długotrwała ekspozycja może powodować oparzenia skóry i owrzodzenia. Nadmierne narażenie przez drogi oddechowe może powodować podrażnienie dróg oddechowych..
Zapalenie oka charakteryzuje się zaczerwienieniem, łzawieniem i swędzeniem. Zapalenie skóry charakteryzuje się swędzeniem, łuszczeniem się, zaczerwienieniem lub czasami powstawaniem pęcherzy.
W przypadku kontaktu z oczami należy sprawdzić, czy nosisz soczewki kontaktowe i je zdjąć. Oczy należy natychmiast przemywać bieżącą wodą przez co najmniej 15 minut, trzymając powieki otwarte..
W przypadku kontaktu ze skórą zanieczyszczoną skórę delikatnie i ostrożnie przemyć bieżącą wodą i nieściernym mydłem. Można użyć zimnej wody. Podrażnioną skórę należy pokryć emolientem.
W przypadku silnego kontaktu ze skórą należy ją przemyć mydłem dezynfekującym, a skażoną skórę pokryć kremem antybakteryjnym..
W przypadku wdychania poszkodowanego należy pozwolić odpocząć w dobrze wentylowanym miejscu..
Jak najszybciej ewakuuj ofiarę w bezpieczne miejsce. Poluzuj ciasną odzież, taką jak kołnierzyk koszuli, pasek lub krawat. Jeśli oddychanie jest utrudnione, podaj tlen. Jeśli ofiara nie oddycha, przeprowadzić resuscytację usta-usta.
W przypadku połknięcia nie należy wywoływać wymiotów. Jeśli ofiara nie oddycha, przeprowadzić resuscytację usta-usta.
We wszystkich przypadkach należy natychmiast zwrócić się o pomoc lekarską (Karta charakterystyki substancji niebezpiecznej Nadtlenek sodu, 2013).
Aplikacje
Nadtlenek sodu jest stosowany w wybielaczach odzieży, ponieważ reaguje z wodą, tworząc nadtlenek wodoru, środek wybielający zgodnie z reakcją:
NadwaLUBdwa + 2 godzdwaO → 2 NaOH + HdwaLUBdwa
Oprócz nadtlenku wodoru w wyniku reakcji powstaje wodorotlenek sodu (ług), który utrzymuje alkaliczność roztworu. Gorąca woda i roztwór alkaliczny są niezbędne, aby nadtlenek wodoru działał najlepiej jako wybielacz (Field, S.F.).
Nadtlenek sodu jest używany do wybielania pulpy drzewnej do produkcji papieru i tekstyliów. Obecnie jest używany głównie do specjalistycznych operacji laboratoryjnych, np. Wydobywania minerałów. Ponadto nadtlenek sodu jest stosowany jako środek utleniający w reakcjach chemicznych..
Jest również używany jako źródło tlenu w reakcji z dwutlenkiem węgla w celu wytworzenia tlenu i węglanu sodu, dlatego jest szczególnie przydatny w sprzęcie do nurkowania, łodziach podwodnych itp. (Wykorzystanie nadtlenku sodu do oczyszczenia emisji dwutlenku węgla, 2014).
Bibliografia
- Ashford, R. (1994). Ashford's Dictionary of Industrial Chemicals. Londyn: Publications Ltd.
- Field, S. (S.F.). Składniki -Nadtlenek sodu. Pobrane z sci-toys.com.
- Karta charakterystyki materiału Nadtlenek sodu. (2013, 21 maja). Odzyskany z sciencelab.com.
- Narodowe Centrum Informacji Biotechnologicznej. (S.F.). Baza danych PubChem Compound; CID = 14803. Odzyskane z PubChem.
- Królewskie Towarzystwo Chemii. (2015). Nadtlenek sodu. Pobrane z chemspider.com.
- SCHOW, H. R. (1957). Historia produkcji nadtlenku sodu. Advances in Chemistry, tom 19, 118-123.
- NADTLENEK SODU. (2016). Pobrane z kamei chemicznych.
- Sód: nadtlenek sodu. (1993-2016). Pobrane z elementów internetowych.
- Stosowanie nadtlenku sodu do oczyszczania emisji dwutlenku węgla. (10 listopada 2014). Pobrane z wymiany stosów.



Jeszcze bez komentarzy