
Zasada Aufbau, koncepcja i wyjaśnienie, przykłady
Plik Zasada Aufbau Składa się z przydatnego przewodnika do teoretycznego przewidywania konfiguracji elektronicznej elementu. Słowo aufbau odnosi się do niemieckiego czasownika „budować”. Reguły podyktowane tą zasadą mają „pomóc w budowie atomu”.
Mówiąc o hipotetycznej budowie atomu, mamy na myśli wyłącznie elektrony, które z kolei idą w parze z rosnącą liczbą protonów. Protony definiują liczbę atomową Z pierwiastka chemicznego, a do każdego dodanego do jądra atomu dodawany jest elektron, aby skompensować ten wzrost dodatniego ładunku..
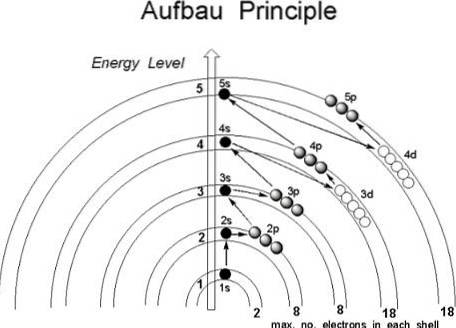
Chociaż wydaje się, że protony nie podążają za ustaloną kolejnością dołączania do jądra atomu, elektrony podążają za szeregiem warunków, w taki sposób, że najpierw zajmują obszary atomu o niższej energii, szczególnie te, w których prawdopodobieństwo znalezienia ich w kosmosie jest większe: orbitale.
Zasada Aufbau wraz z innymi regułami wypełniania elektronicznego (zasada wykluczenia Pauliego i reguła Hunda) pomaga ustalić kolejność, w jakiej elektrony powinny być dodawane do chmury elektronów; w ten sposób można przypisać odpowiednią konfigurację elektronową określonego pierwiastka chemicznego.
Indeks artykułów
- 1 Pojęcie i wyjaśnienie
- 1.1 Warstwy i podwarstwy
- 1.2 Zasada wykluczenia Pauliego i reguła Hunda
- 2 Przykłady
- 2.1 Węgiel
- 2.2 Tlen
- 2.3 Wapń
- 3 Ograniczenia zasady Aufbau
- 4 Odnośniki
Pojęcie i wyjaśnienie
Gdyby atom potraktować tak, jakby był cebulą, znajdowałaby się w nim skończona liczba warstw, określona przez główną liczbę kwantową n.
Ponadto wewnątrz nich znajdują się podpowłoki, których kształty zależą od liczb kwantowych azymutalnych l i magnetycznych m.
Orbitale są identyfikowane przez pierwsze trzy liczby kwantowe, podczas gdy czwarta, spin s, kończy się wskazaniem, na której orbicie będzie się znajdować elektron. To właśnie w tych obszarach atomu obracają się elektrony, od najbardziej wewnętrznej do najbardziej zewnętrznej warstwy: warstwa walencyjna, najbardziej energetyczna ze wszystkich..
Skoro tak jest, w jakiej kolejności elektrony powinny wypełniać orbitale? Zgodnie z zasadą Aufbau należy je przypisać na podstawie rosnącej wartości (n + l).
Podobnie w podpowłokach (n + l) elektrony muszą zajmować podpowłokę o najniższej wartości energii; innymi słowy, zajmują najniższą wartość n.
Kierując się tymi zasadami konstrukcyjnymi, Madelung opracował wizualną metodę polegającą na rysowaniu ukośnych strzałek, które pomagają zbudować elektroniczną konfigurację atomu. W niektórych obszarach edukacyjnych ta metoda jest również znana jako metoda deszczowa..
Warstwy i podwarstwy
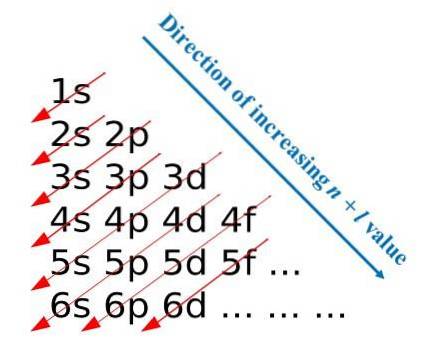
Pierwszy obraz ilustruje graficzną metodę uzyskiwania konfiguracji elektronów, podczas gdy drugi obraz przedstawia odpowiednią metodę Madelunga. Najbardziej energetyczne warstwy znajdują się na górze, a najmniej energetyczne na dole..
Od lewej do prawej podwarstwy s, p, d i f odpowiadających im głównych poziomów energii są „tranzytem”. Jak obliczyć wartość (n + l) dla każdego kroku oznaczonego ukośnymi strzałkami? Na przykład dla orbitalu 1s to obliczenie jest równe (1 + 0 = 1), dla orbitalu 2s (2 + 0 = 2) i dla orbitalu 3p (3 + 1 = 4).
Wynik tych obliczeń zapoczątkowuje konstrukcję obrazu. Dlatego jeśli nie jest dostępny pod ręką, po prostu określ (n + l) dla każdego orbitalu, zaczynając wypełniać orbitale elektronami od tego o najniższej wartości (n + l) do tego o maksymalnej wartości.
Jednak użycie metody Madelunga znacznie ułatwia budowę konfiguracji elektronowej i sprawia, że jest to zabawne zajęcie dla tych, którzy uczą się układu okresowego..
Zasada wykluczenia Pauliego i reguła Hunda
Metoda Madelunga nie wskazuje orbitali podpowłok. Biorąc je pod uwagę, zasada wykluczenia Pauliego stwierdza, że żaden elektron nie może mieć takich samych liczb kwantowych jak inny; lub co jest tym samym, para elektronów nie może mieć zarówno dodatnich, jak i ujemnych spinów.
Oznacza to, że ich spinowe liczby kwantowe s nie mogą być równe i dlatego ich spiny muszą się łączyć, gdy zajmują ten sam orbital.
Z drugiej strony wypełnienie orbitali musi być wykonane w taki sposób, aby były zdegenerowane energetycznie (reguła Hunda). Osiąga się to poprzez utrzymywanie wszystkich elektronów na orbitaliach w stanie niesparowanym, dopóki nie będzie konieczne sparowanie ich pary (jak w przypadku tlenu).
Przykłady
Poniższe przykłady podsumowują całą koncepcję zasady Aufbau..
Węgiel
Aby określić jego konfigurację elektroniczną, należy najpierw poznać liczbę atomową Z, a tym samym liczbę elektronów. Węgiel ma Z = 6, więc jego 6 elektronów musi znajdować się na orbitalach metodą Madelunga:

Strzałki odpowiadają elektronom. Po wypełnieniu orbitali 1s i 2s, każdy z dwoma elektronami, orbitalom 2p przez różnicę przypisuje się pozostałe dwa elektrony. W ten sposób manifestuje się reguła Hunda: dwa zdegenerowane orbitale i jeden pusty.
Tlen

Tlen ma Z = 8, więc w przeciwieństwie do węgla ma dwa dodatkowe elektrony. Jeden z tych elektronów musi być umieszczony na pustym orbicie 2p, a drugi musi zostać sparowany, aby utworzyć pierwszą parę, ze strzałką skierowaną w dół. W konsekwencji przejawia się tutaj zasada wykluczenia Pauliego.
Wapń
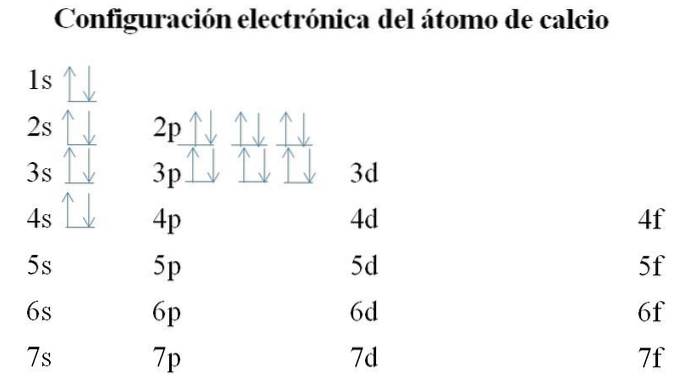
Wapń ma 20 elektronów, a orbitale są nadal wypełnione tą samą metodą. Kolejność wypełniania jest następująca: 1s-2s-2p-3s-3p-4s.
Można zauważyć, że zamiast najpierw wypełnić orbital 3d, elektrony zajmują 4s. Dzieje się to przed utworzeniem miejsca dla metali przejściowych, czyli elementów wypełniających wewnętrzną warstwę 3d.
Ograniczenia zasady Aufbau
Zasada Aufbau nie pozwala przewidzieć konfiguracji elektronicznych wielu metali przejściowych i pierwiastków ziem rzadkich (lantanowców i aktynowców).
Dzieje się tak, ponieważ różnice energetyczne między orbitalami ns i (n-1) d są małe. Z powodów popartych mechaniką kwantową elektrony mogą preferować zdegenerowanie orbitali (n-1) d kosztem cofania lub przemieszczania elektronów z orbity ns..
Znanym przykładem jest przypadek miedzi. Jego konfiguracja elektronowa przewidziana przez zasadę Aufbau to 1sdwa2sdwa2 P63sdwa3p64sdwa3d9, kiedy eksperymentalnie wykazano, że wynosi 1sdwa2sdwa2 P63sdwa3p64s13d10.
W pierwszym pojedynczy elektron nie jest sparowany na orbicie 3d, podczas gdy w drugim wszystkie elektrony na orbitali 3d są sparowane..
Bibliografia
- Helmenstine, dr Anne Marie (15 czerwca 2017). Definicja zasady Aufbau. Zaczerpnięte z: thinkco.com
- Prof. N. De Leon. (2001). Zasada Aufbau. Zaczerpnięte z: iun.edu
- Chemia 301. Zasada Aufbau. Zaczerpnięte z: ch301.cm.utexas.edu
- Hozefa Arsiwala i teacherlookup.com. (1 czerwca 2017). W głębi: Zasada Aufbau z przykładami. Zaczerpnięte z: teacherlookup.com
- Whitten, Davis, Peck & Stanley. Chemia. (8th ed.). CENGAGE Learning, str. 199–203.
- Goodphy. (27 lipca 2016). Schemat Madelung. [Postać]. Zaczerpnięte z: commons.wikimedia.org


Jeszcze bez komentarzy