
Izochoryczne wzory procesów i obliczenia, codzienne przykłady

ZA proces izochoryczny To wszystkie procesy termodynamiczne, w których objętość pozostaje stała. Procesy te są często nazywane również izometrycznymi lub izowolumetrycznymi. Ogólnie proces termodynamiczny może zachodzić przy stałym ciśnieniu i dlatego nazywa się go izobarycznym.
Gdy zachodzi w stałej temperaturze, w takim przypadku mówi się, że jest to proces izotermiczny. Jeśli nie ma wymiany ciepła między systemem a otoczeniem, nazywa się to adiabatycznym. Z drugiej strony, gdy istnieje stała objętość, generowany proces nazywa się izochoryczny.
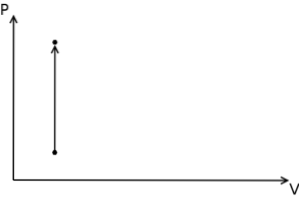
W przypadku procesu izochorycznego można stwierdzić, że w tych procesach praca ciśnieniowo-objętościowa jest zerowa, gdyż wynika to z pomnożenia ciśnienia przez przyrost objętości.
Ponadto na termodynamicznym wykresie ciśnienie-objętość procesy izochoryczne są przedstawiane w postaci pionowej linii prostej..
Indeks artykułów
- 1 Wzory i obliczenia
- 1.1 Pierwsza zasada termodynamiki
- 2 Przykłady z życia codziennego
- 2.1 Idealny cykl Otto
- 3 Praktyczne przykłady
- 3.1 Pierwszy przykład
- 3.2 Drugi przykład
- 4 Odnośniki
Wzory i obliczenia
Pierwsza zasada termodynamiki
W termodynamice pracę oblicza się na podstawie następującego wyrażenia:
W = P ∙ ∆ V
W tym wyrażeniu W jest pracą mierzoną w dżulach, P jest ciśnieniem mierzonym w niutonach na metr kwadratowy, a ∆ V jest zmianą lub wzrostem objętości mierzonej w metrach sześciennych..
Podobnie, tak zwana pierwsza zasada termodynamiki stanowi, że:
∆ U = Q - W
W tym wzorze W jest pracą wykonaną przez system lub w systemie, Q jest ciepłem odebranym lub wyemitowanym przez system, oraz ∆ U jest wewnętrzną zmiennością energii systemu. W tym przypadku trzy wielkości są mierzone w dżulach.
Ponieważ w procesie izochorycznym praca jest zerowa, okazuje się, że:
∆ U = QV (ponieważ ∆ V = 0, a więc W = 0)
Innymi słowy, zmiana energii wewnętrznej systemu wynika wyłącznie z wymiany ciepła między systemem a otoczeniem. W tym przypadku przenoszone ciepło nazywa się ciepłem o stałej objętości..
Pojemność cieplna ciała lub układu wynika z podzielenia ilości energii w postaci ciepła przekazanego do ciała lub układu w danym procesie oraz zmiany temperatury przez niego odczuwanej..
Gdy proces odbywa się przy stałej objętości, mówimy o pojemności cieplnej przy stałej objętości i oznaczamy go Cv (molowa pojemność cieplna).
W takim przypadku zostanie to spełnione:
Qv = n ∙ Cv ∙ ∆T
W tej sytuacji n to liczba moli, Cv jest wspomnianą wyżej molową pojemnością cieplną przy stałej objętości, a ΔT jest wzrostem temperatury ciała lub układu.
Przykłady z życia codziennego
Łatwo wyobrazić sobie proces izochoryczny, wystarczy pomyśleć o procesie, który zachodzi przy stałej objętości; to znaczy, w którym pojemnik zawierający materię lub system materialny nie zmienia swojej objętości.
Przykładem może być przypadek (idealnego) gazu zamkniętego w zamkniętym pojemniku, którego objętości nie można zmienić w żaden sposób, do którego doprowadzane jest ciepło. Przypuśćmy przypadek gazu zamkniętego w butli.
Przenosząc ciepło do gazu, jak już wyjaśniono, spowoduje to wzrost lub wzrost jego energii wewnętrznej.
Odwrotny proces byłby taki, jak w przypadku gazu zamkniętego w pojemniku, którego objętości nie można zmienić. Gdyby gaz został schłodzony i oddał ciepło do otoczenia, to ciśnienie gazu by się zmniejszyło, a wartość energii wewnętrznej gazu zmniejszyłaby się.
Idealny cykl Otto
Cykl Otto jest idealnym przypadkiem cyklu używanego przez maszyny benzynowe. Jednak jego początkowe zastosowanie było w maszynach, które wykorzystywały gaz ziemny lub inne rodzaje paliw w stanie gazowym..
W każdym razie idealny cykl Otto jest interesującym przykładem procesu izochorycznego. Występuje, gdy w samochodzie spalinowym spalanie mieszanki benzyny z powietrzem następuje natychmiastowo.
W tym przypadku następuje wzrost temperatury i ciśnienia gazu wewnątrz butli, przy czym objętość pozostaje stała..
Praktyczne przykłady
Pierwszy przykład
Biorąc pod uwagę (idealny) gaz zamknięty w cylindrze wyposażonym w tłok, wskazać, czy poniższe przypadki są przykładami procesów izochorycznych.
- Praca na gazie wynosi 500 J..
W tym przypadku nie byłby to proces izochoryczny, ponieważ do pracy na gazie konieczne jest jego sprężenie, a tym samym zmiana jego objętości.
- Gaz rozszerza się, przesuwając tłok w poziomie.
Ponownie nie byłby to proces izochoryczny, ponieważ ekspansja gazu pociąga za sobą zmianę jego objętości.
- Tłok cylindra jest zamocowany tak, że nie może się poruszać, a gaz jest chłodzony.
Tym razem byłby to proces izochoryczny, ponieważ nie byłoby wahań objętości.
Drugi przykład
Określić zmianę energii wewnętrznej, jakiej doświadczy gaz zawarty w pojemniku o objętości 10 litrów poddany ciśnieniu 1 atm, jeśli jego temperatura wzrośnie z 34 ° C do 60 ° C w procesie izochorycznym, znanym jako jego molowe ciepło właściwe. dov = 2,5R (istota R = 8,31 J / mol K).
Ponieważ jest to proces o stałej objętości, wewnętrzna zmiana energii będzie występować tylko w wyniku ciepła dostarczanego do gazu. Określa się to za pomocą następującego wzoru:
Qv = n ∙ Cv ∙ ∆T
Aby obliczyć dostarczone ciepło, należy najpierw obliczyć liczbę moli gazu zawartego w zbiorniku. W tym celu konieczne jest odwołanie się do równania gazu doskonałego:
P ∙ V = n ∙ R ∙ T
W tym równaniu n to liczba moli, R to stała o wartości 8,31 J / molK, T to temperatura, P to ciśnienie, któremu poddawany jest gaz mierzone w atmosferach, a T to temperatura mierzona w kelwinach.
Rozwiąż n i uzyskaj:
n = R ∙ T / (P ∙ V) = 0,39 mola
Po to aby:
∆ U = QV = n ∙ Cv ∙ ∆T = 0,39 ∙ 2,5 ∙ 8,31 ∙ 26 = 210,65 J.
Bibliografia
- Resnik, Halliday i Krane (2002). Fizyka Tom 1. Cecsa.
- Laider, Keith, J. (1993). Oxford University Press, wyd. Świat chemii fizycznej.
- Pojemność cieplna. (b.d.) W Wikipedii. Pobrane 28 marca 2018 r. Z en.wikipedia.org.
- Ciepło. (b.d.) W Wikipedii. Pobrane 28 marca 2018 r. Z en.wikipedia.org.
- Proces izochoryczny. (b.d.) W Wikipedii. Pobrane 28 marca 2018 r. Z en.wikipedia.org.



Jeszcze bez komentarzy