
Charakterystyka procesu politropowego, zastosowania i przykłady
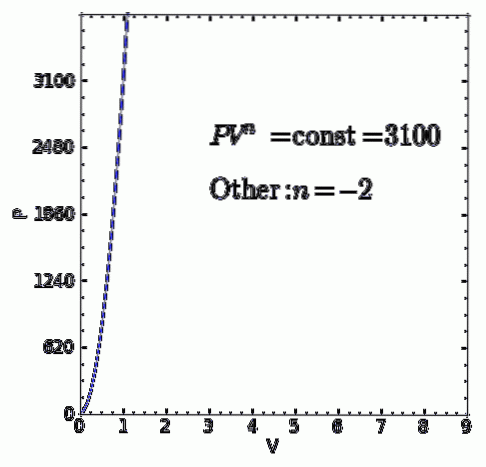
ZA proces politropowy jest procesem termodynamicznym, który zachodzi, gdy związek między ciśnieniem P. i głośność V podane przez P.Vn pozostaje niezmienna. Wykładnik n jest liczbą rzeczywistą, zwykle od zera do nieskończoności, ale w niektórych przypadkach może być ujemna.
Wartość n otrzymuje nazwę indeks politropowy i ważne jest, aby podkreślić, że podczas politropowego procesu termodynamicznego wspomniany wskaźnik musi utrzymywać stałą wartość, w przeciwnym razie proces nie zostanie uznany za politropowy.

Indeks artykułów
- 1 Charakterystyka procesów politropowych
- 2 Aplikacje
- 2.1 Praca nad procesami politropowymi dla różnych wartości n
- 3 Przykłady procesów politropowych
- 3.1 - Przykład 1
- 3.2 - Przykład 2
- 4 Odnośniki
Charakterystyka procesów politropowych
Niektóre charakterystyczne przypadki procesów politropowych to:
- Proces izotermiczny (w stałej temperaturze T), w którym wykładnik wynosi n = 1.
- Proces izobaryczny (przy stałym ciśnieniu P), w tym przypadku n = 0.
- Proces izochoryczny (przy stałej objętości V), dla którego n = + ∞.
- Procesy adiabatyczne (przy stałej entropii S), w których wykładnikiem jest n = γ, gdzie γ jest stałą adiabatyczną. Ta stała jest ilorazem pojemności cieplnej przy stałym ciśnieniu Cp podzielonej przez pojemność cieplną przy stałej objętości Cv:
γ = Cp / Cv
- Każdy inny proces termodynamiczny, który nie jest jednym z poprzednich przypadków. ale to się zgadza P.Vn = ctte z rzeczywistym i stałym indeksem politropy n będzie to również proces politropowy.
Aplikacje
Jednym z głównych zastosowań równania politropowego jest obliczenie pracy wykonywanej przez zamknięty układ termodynamiczny, gdy przechodzi on od stanu początkowego do stanu końcowego w sposób quasi-statyczny, czyli po kolejnych stanach równowagi.
Pracuj nad procesami politropowymi dla różnych wartości n
Dla n ≠ 1
Pracę mechaniczną W wykonywaną przez zamknięty układ termodynamiczny oblicza się ze wzoru:
W = ∫P.dV
Gdzie P to ciśnienie, a V objętość.
Podobnie jak w przypadku politropu, zależność między ciśnieniem a objętością jest następująca:
P.V n = stała = C
Szukanie P z poprzedniego wyrażenia w celu zastąpienia go w wyrażeniu roboczym:
P = C /V n
Mamy pracę mechaniczną wykonaną podczas procesu politropy, który rozpoczyna się w stanie początkowym 1, a kończy w stanie końcowym 2. Wszystko to pojawia się w następującym wyrażeniu:


C = P1 V1n = Pdwa Vdwan
Podstawiając wartość stałej w wyrażeniu roboczym, otrzymujemy:
W = (Pdwa Vdwa - P.1 V1) / (1-n)
W przypadku, gdy substancję roboczą można zamodelować jako gaz doskonały, mamy następujące równanie stanu:
P.V = m.R.T.
Gdzie m to liczba moli gazu doskonałego, a R to uniwersalna stała gazu.
Dla gazu doskonałego, który następuje po procesie politropu z indeksem politropu różnym od jedności i który przechodzi ze stanu o początkowej temperaturze T1 do innego stanu z temperaturą Tdwa mamy, że wykonaną pracę daje następujący wzór:
W = m R (T.dwa - T1) / (1-n)
Dla n → ∞
Zgodnie ze wzorem na pracę otrzymaną w poprzedniej sekcji mamy, że praca procesu politropowego z n = ∞ jest zerowa, ponieważ wyrażenie pracy jest podzielone przez nieskończoność, a zatem wynik dąży do zera.
Innym sposobem uzyskania tego wyniku jest relacja P.1 V1n = Pdwa Vdwan, który można przepisać w następujący sposób:
(Str1/ Pdwa) = (Vdwa/ V1)n
Biorąc n-ty pierwiastek w każdym członku, otrzymujemy:
(Vdwa/ V1) = (P1/ Pdwa)(1 / n)
W przypadku, gdy n → ∞, mamy (Vdwa/ V1) = 1, co oznacza, że:
Vdwa = V1
Oznacza to, że objętość nie zmienia się w procesie politropy przy n → ∞. Dlatego różnica objętości dV w całce pracy mechanicznej wynosi 0. Te typy procesów politropowych są również znane jako procesy izochoryczny, lub procesy o stałej objętości.
Dla n = 1
Znowu mamy wyrażenie na pracę:
W = ∫P dV
W przypadku politropy z n = 1, zależność między ciśnieniem a objętością jest następująca:
P V = stała = C
Rozwiązując dla P z poprzedniego wyrażenia i podstawiając, wykonaliśmy pracę, aby przejść od stanu początkowego 1 do stanu końcowego 2:

Mianowicie:
W = C ln (Vdwa/ V1).
Ponieważ stan początkowy i końcowy są dobrze określone, tak samo będzie z ctte. Mianowicie:
C = P1 V1 = Pdwa Vdwa
Na koniec mamy następujące przydatne wyrażenia, aby znaleźć pracę mechaniczną politropowego systemu zamkniętego, w którym n = 1.
W = P1 V1 ln (Vdwa/ V1) = P.dwa Vdwa ln (Vdwa/ V1)
Jeśli substancja robocza składa się z m moli gazu doskonałego, wówczas można zastosować równanie stanu gazu doskonałego: P V = m.R.T.
W tym przypadku jako P.V1 = ctte, mamy, że proces politropowy z n = 1 jest procesem w stałej temperaturze T (izotermicznej), tak że można otrzymać następujące wyrażenia dla pracy:
W = m R T.1 ln (Vdwa/ V1) = m R Tdwa ln (Vdwa/ V1)

Przykłady procesów politropowych
- Przykład 1
Załóżmy, że cylinder z ruchomym tłokiem jest wypełniony jednym kilogramem powietrza. Początkowo powietrze zajmuje objętość V.1= 0,2 m3 przy ciśnieniu P.1= 400 kPa. Następuje proces politropowy z n = γ = 1,4, którego stan końcowy ma ciśnienie Pdwa = 100 kPa. Określ pracę wykonaną przez powietrze na tłoku.
Rozwiązanie
Gdy indeks politropowy jest równy stałej adiabatycznej, zachodzi proces, w którym substancja robocza (powietrze) nie wymienia ciepła z otoczeniem, a zatem entropia się nie zmienia..
W przypadku powietrza, dwuatomowego gazu doskonałego, mamy:
γ = Cp / Cv, gdzie Cp = (7/2) R i Cv = (5/2) R
Następnie:
γ = 7/5 = 1,4
Korzystając z wyrażenia procesu politropy, można określić końcową objętość powietrza:
Vdwa = [(Pdwa V11.4) / Pdwa](1 / 1,4) = 0,54 m3.
Teraz mamy warunki do zastosowania wzoru do pracy wykonanej w politropowym procesie dla n ≠ 1 otrzymanego powyżej:
W = (Pdwa Vdwa - P1 V1) / (1-n)
Zastępując odpowiednie wartości mamy:
W = (100 kPa 0,54 m3 - 400 kPa 0,2 m3) / (1 - 1,4) = 65,4 kJ
- Przykład 2
Załóżmy, że ten sam cylinder z przykładu 1, z ruchomym tłokiem wypełnionym jednym kilogramem powietrza. Początkowo powietrze zajmuje objętość V1 = 0,2 m3 przy ciśnieniu P1 = 400 kPa. Ale w przeciwieństwie do poprzedniego przypadku powietrze rozszerza się izotermicznie, aby osiągnąć ciśnienie końcowe P2 = 100 kPa. Określ pracę wykonaną przez powietrze na tłoku.
Rozwiązanie
Jak widać wcześniej, procesy izotermiczne są procesami politropowymi o indeksie n = 1, więc prawdą jest, że:
P1 V1 = P2 V2
W ten sposób końcową objętość można łatwo oderwać, aby uzyskać:
V2 = 0,8 m3
Następnie, używając wyrażenia roboczego uzyskanego wcześniej dla przypadku n = 1, otrzymujemy, że praca wykonana przez powietrze na tłoku w tym procesie to:
W = P1 V1 ln (V2 / V1) = 400000 Pa × 0,2 m3 ln (0,8 / 0,2) = 110,9 kJ.
Bibliografia
- Bauer, W. 2011. Fizyka dla inżynierii i nauki. Tom 1. Mc Graw Hill.
- Cengel, rok 2012. Termodynamika. 7th Edition. Mcgraw hill.
- Figueroa, D. (2005). Seria: Fizyka dla nauki i inżynierii. Tom 4. Płyny i termodynamika. Pod redakcją Douglasa Figueroa (USB).
- Lopez, C. Pierwsza zasada termodynamiki. Odzyskany z: culturacientifica.com.
- Knight, R. 2017. Fizyka dla naukowców i inżynierii: podejście strategiczne. osoba.
- Serway, R., Vulle, C. 2011. Podstawy fizyki. 9th Ed. Cengage Learning.
- Uniwersytet w Sewilli. Maszyny termiczne. Odzyskany z: laplace.us.es.
- Wikiwand. Proces politropowy. Odzyskane z: wikiwand.com.


Jeszcze bez komentarzy