
Co to jest widmo emisyjne? (Z przykładami)

Plik spektrum emisji to widmo długości fal światła emitowanego przez atomy i cząsteczki podczas przechodzenia między dwoma stanami energii. Światło białe lub widzialne padające na pryzmat rozkłada się na różne kolory o określonych długościach fal dla każdego koloru. Uzyskany wzór kolorów to widmo promieniowania widzialnego światła, zwane widmem emisyjnym.
Atomy, cząsteczki i substancje mają również widmo emisyjne ze względu na emisję światła, gdy pochłaniają odpowiednią ilość energii z zewnątrz, aby przejść między dwoma stanami energetycznymi. Przepuszczając to światło przez pryzmat, rozkłada się ono na kolorowe linie o różnych długościach fal każdego elementu..
Znaczenie widma emisyjnego polega na tym, że pozwala ono określić skład nieznanych substancji i obiektów astronomicznych poprzez analizę ich linii widmowych za pomocą technik spektroskopii emisyjnej..
Następnie wyjaśniono, z czego składa się widmo emisyjne i jak jest interpretowane, przytoczono kilka przykładów oraz różnice, które istnieją między widmem emisyjnym i absorpcyjnym..
Indeks artykułów
- 1 Co to jest widmo emisyjne?
- 2 Interpretacja widma emisyjnego
- 3 Różnica między widmem emisyjnym a widmem absorpcyjnym.
- 4 Przykłady widm emisyjnych pierwiastków chemicznych
- 5 Referencje
Co to jest widmo emisyjne?
Atomy pierwiastka lub substancji mają elektrony i protony, które są utrzymywane razem dzięki elektromagnetycznej sile przyciągania. Zgodnie z modelem Bohra elektrony są ułożone w taki sposób, aby energia atomu była jak najmniejsza. Ten poziom energii nazywany jest stanem podstawowym atomu..
Kiedy atomy pobierają energię z zewnątrz, elektrony przemieszczają się w kierunku wyższego poziomu energii, a atom zmienia swój stan podstawowy na stan wzbudzony..
W stanie wzbudzonym czas przebywania elektronu jest bardzo mały (≈ 10-8 s) (1), atom jest niestabilny i powraca do stanu podstawowego, przechodząc, jeśli to konieczne, przez pośrednie poziomy energii.
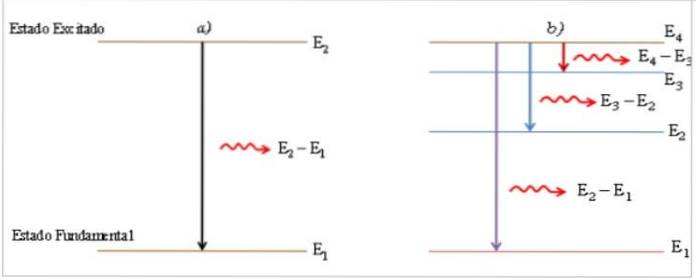
W procesie przejścia ze stanu wzbudzonego do stanu podstawowego atom emituje foton światła o energii równej różnicy energii między dwoma stanami, bezpośrednio proporcjonalnej do częstotliwości v i odwrotnie proporcjonalnej do jego długości fali λ.
Wyemitowany foton jest pokazany jako jasna linia, zwana linią widmową (2), a widmowy rozkład energii zbioru emitowanych fotonów na przejściach atomu to widmo emisyjne.
Interpretacja widma emisyjnego
Niektóre przejścia atomów są spowodowane wzrostem temperatury lub obecnością innych zewnętrznych źródeł energii, takich jak wiązka światła, prąd elektronów lub reakcja chemiczna..
Jeśli gaz, taki jak wodór, zostanie umieszczony w komorze pod niskim ciśnieniem i przez komorę przepłynie prąd elektryczny, gaz będzie emitował światło o własnym kolorze, które odróżnia go od innych gazów..
Przepuszczając emitowane światło przez pryzmat, zamiast uzyskać tęczę światła, uzyskuje się dyskretne jednostki w postaci kolorowych linii o określonych długościach fal, które niosą dyskretne ilości energii..
Linie widma emisyjnego są unikalne w każdym pierwiastku, a ich wykorzystanie z techniki spektroskopii pozwala określić skład pierwiastkowy nieznanej substancji, a także skład obiektów astronomicznych, analizując długości fal emitowanych fotonów. Podczas przejścia atomu.
Różnica między widmem emisyjnym a widmem absorpcyjnym.
W procesach absorpcji i emisji atom przechodzi między dwoma stanami energetycznymi, ale właśnie w trakcie absorpcji pozyskuje energię z zewnątrz i osiąga stan wzbudzenia..
Widmowa linia emisji jest przeciwna do ciągłego widma światła białego. W pierwszym rozkład widmowy obserwuje się w postaci jasnych linii, aw drugim ciągłe pasmo kolorów..
Jeśli wiązka białego światła trafi w gaz, taki jak wodór, zamknięty w komorze o niskim ciśnieniu, tylko część światła zostanie pochłonięta przez gaz, a reszta zostanie przesłana.
Kiedy przepuszczane światło przechodzi przez pryzmat, rozpada się na linie widmowe, z których każda ma inną długość fali, tworząc widmo absorpcyjne gazu..
Widmo absorpcji jest całkowicie przeciwne do widma emisyjnego i jest również specyficzne dla każdego pierwiastka. Porównując oba widma tego samego pierwiastka, obserwuje się, że widmowe linie emisyjne są tymi, których brakuje w widmie absorpcyjnym (ryc.2).
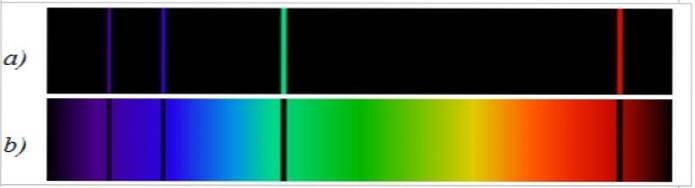
Przykłady widm emisyjnych pierwiastków chemicznych
a) Linie widmowe atomu wodoru w widzialnym obszarze widma to czerwona linia o długości 656,3 nm, jasnoniebieska o długości 486,1 nm, ciemnoniebieska o długości 434 nm i bardzo słaba fioletowa o 410 nm. Te długości fal są otrzymywane z równania Balmera-Rydberga w jego nowoczesnej wersji (3).
jest liczbą falową linii widmowej
jest stałą Rydberga (109666,56 cm-1)
to najwyższy poziom energii
to najwyższy poziom energii

b) Widmo emisyjne helu ma dwie serie głównych linii, jedną w obszarze widzialnym, a drugą w pobliżu ultrafioletu. Peterson (4) wykorzystał model Bohra do obliczenia szeregu linii emisyjnych helu w widzialnej części widma, w wyniku kilku równoczesnych przejść dwóch elektronów do stanu n = 5 i otrzymano wartości długości fali zgodne z wynikami eksperymentalnymi. Uzyskane długości fal to 468,8nm, 450,1nm, 426,3nm, 418,4nm, 412,2nm, 371,9nm.
c) Widmo emisyjne sodu ma dwie bardzo jasne linie 589nm i 589,6nm zwane liniami D (5). Pozostałe linie są znacznie słabsze niż te i ze względów praktycznych uważa się, że całe światło sodowe pochodzi z linii D..
Bibliografia
- Pomiar czasów życia stanów wzbudzonych atomu wodoru. V. A. Ankudinov, S. V. Bobashev i E. P. Andreev. 1, 1965, Soviet Physics JETP, tom 21, s. 26-32.
- Demtröder, W. Spektroskopia laserowa 1. Kaiserslautern: Springer, 2014.
- D.K. Rai, S.N Thakur i. Atom, laser i spektroskopia. New Delhi: Phi Learning, 2010.
- Bohr Revisited: Model i widmowe linie helu. Peterson, C. 5, 2016, Dziennik młodych badaczy, t. 30, s. 32-35.
- Journal of Chemical Education. J.R. Appling, F. J. Yonke, R. A. Edgington i S. Jacobs. 3, 1993, tom 70, str. 250-251.



Jeszcze bez komentarzy