
Co to jest roztwór nasycony? (z przykładami)

ZA roztwór nasycony Jest to roztwór chemiczny zawierający maksymalne stężenie substancji rozpuszczonej w rozpuszczalniku. Uważa się, że jest to stan równowagi dynamicznej, w którym prędkości, z którymi rozpuszczalnik rozpuszcza substancję rozpuszczoną, i prędkość rekrystalizacji są równe (J., 2014)..
Dodatkowa substancja rozpuszczona nie rozpuści się w nasyconym roztworze i pojawi się w innej fazie, albo w postaci osadu, jeśli jest ciałem stałym w cieczy, albo w postaci musującej, jeśli jest gazem w cieczy (Anne Marie Helmenstine, 2016).
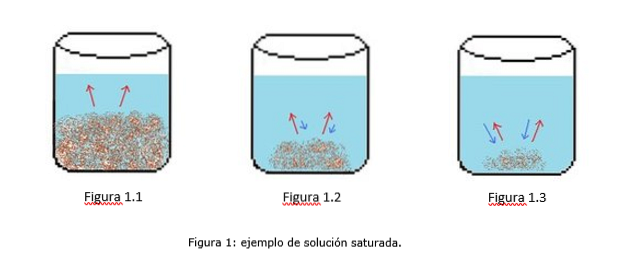
Przykład roztworu nasyconego przedstawiono na rysunku 1. Na rysunkach 1.1, 1.2 i 1.3 w zlewce znajduje się stała objętość wody. Na rysunku 1.1 rozpoczyna się proces nasycania, w którym substancja rozpuszczona zaczyna się rozpuszczać, co jest pokazane czerwonymi strzałkami.
Na rysunku 1.2 duża część ciała stałego rozpuściła się, ale nie całkowicie z powodu procesu rekrystalizacji, co zaznaczają niebieskie strzałki..
Na rysunku 1.3 tylko niewielka ilość substancji rozpuszczonej pozostaje nierozpuszczona. W tym przypadku szybkość rekrystalizacji jest większa niż szybkość rozpuszczania. (tipes of saturation, 2014)
Punkt maksymalnego stężenia substancji rozpuszczonej w rozpuszczalniku jest nazywany punktem nasycenia.
Indeks artykułów
- 1 Czynniki wpływające na nasycenie
- 1.1 Temperatura
- 1.2 Ciśnienie
- 1.3 Skład chemiczny
- 1.4 Czynniki mechaniczne
- 2 Krzywe nasycenia i rozpuszczalności
- 3 Przykłady roztworów nasyconych
- 4 Co to jest roztwór przesycony?
- 5 Referencje
Czynniki wpływające na nasycenie
Ilość substancji rozpuszczonej, którą można rozpuścić w rozpuszczalniku, będzie zależała od różnych czynników, wśród nich najważniejsze to:
Temperatura
Rozpuszczalność wzrasta wraz z temperaturą. Na przykład więcej soli można rozpuścić w gorącej wodzie niż w zimnej wodzie..
Jednak mogą być wyjątki, na przykład rozpuszczalność gazów w wodzie spada wraz ze wzrostem temperatury. W tym przypadku cząsteczki substancji rozpuszczonej podczas nagrzewania otrzymują energię kinetyczną, co ułatwia ich ucieczkę..
Nacisk
Zwiększone ciśnienie może wymusić rozpuszczenie substancji rozpuszczonej. Jest to powszechnie używane do rozpuszczania gazów w cieczach..
Skład chemiczny
Charakter substancji rozpuszczonej i rozpuszczalnika oraz obecność innych związków chemicznych w roztworze wpływa na rozpuszczalność. Na przykład w wodzie można rozpuścić więcej cukru niż soli w wodzie. W tym przypadku mówi się, że cukier jest bardziej rozpuszczalny.
Etanol w wodzie są całkowicie wzajemnie rozpuszczalne. W tym konkretnym przypadku rozpuszczalnikiem będzie związek znajdujący się w największej ilości.
Czynniki mechaniczne
W przeciwieństwie do szybkości rozpuszczania, która zależy głównie od temperatury, szybkość rekrystalizacji zależy od stężenia substancji rozpuszczonej na powierzchni sieci krystalicznej, co jest korzystne, gdy roztwór jest nieruchomy.
W związku z tym, mieszanie roztworu unika tej akumulacji, maksymalizując rozpuszczanie (końcówki nasycenia, 2014).
Krzywe nasycenia i rozpuszczalności
Krzywe rozpuszczalności są graficzną bazą danych, w której porównuje się ilość substancji rozpuszczonej w pewnej ilości rozpuszczalnika w określonej temperaturze.
Krzywe rozpuszczalności są zwykle wykreślane dla ilości substancji rozpuszczonej, ciała stałego lub gazu, w 100 gramach wody (Brian, 2014).
Rysunek 2 ilustruje krzywe nasycenia dla różnych substancji rozpuszczonych w wodzie..
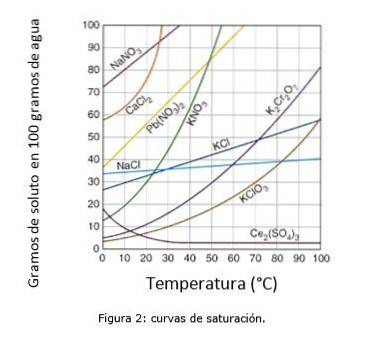
Na osi współrzędnych mamy temperaturę w stopniach Celsjusza, a na osi odciętych stężenie substancji rozpuszczonej wyrażone w gramach substancji rozpuszczonej na 100 gramów wody.
Krzywa wskazuje punkt nasycenia w danej temperaturze. Obszar pod krzywą wskazuje, że masz roztwór nienasycony i dlatego można dodać więcej substancji rozpuszczonej..
Obszar powyżej krzywej zawiera przesycony roztwór. (Krzywe rozpuszczalności, b.d.)
Biorąc na przykład chlorek sodu (NaCl), przy 25 stopniach Celsjusza około 35 gramów NaCl można rozpuścić w 100 gramach wody w celu uzyskania nasyconego roztworu. (Uniwersytet Cambrige, s.f.)
Przykłady roztworów nasyconych
Roztwory nasycone można znaleźć na co dzień, nie ma potrzeby przebywania w laboratorium chemicznym. Rozpuszczalnikiem niekoniecznie musi być woda. Poniżej znajdują się codzienne przykłady nasyconych rozwiązań:
-Soda i napoje bezalkoholowe to na ogół nasycone roztwory dwutlenku węgla w wodzie. Dlatego po zwolnieniu ciśnienia tworzą się bąbelki dwutlenku węgla..
-Gleby ziemne są nasycone azotem.
-Do octu można dodać cukier lub sól, aby uzyskać nasycony roztwór..
-Dodaj sproszkowaną czekoladę do mleka, aż się nie rozpuści, utworzy nasycony roztwór.
-Mleko można nasycić mąką do tego stopnia, że nie można do niego więcej dodać mąki.
-Roztopione masło można nasycić solą, gdy sól już się nie rozpuszcza.
Co to jest roztwór przesycony?
Definicja przesyconego roztworu to taki, który zawiera więcej rozpuszczonej substancji rozpuszczonej niż normalnie można byłoby rozpuścić w rozpuszczalniku. Odbywa się to zwykle poprzez podwyższenie temperatury roztworu..
Niewielka zmiana roztworu lub wprowadzenie „zarodka” lub małego kryształu substancji rozpuszczonej wymusi krystalizację nadmiaru substancji rozpuszczonej. Jeśli nie ma punktu zarodkowania dla tworzenia kryształów, nadmiar substancji rozpuszczonej może pozostać w roztworze.
Inna forma przesycenia może wystąpić, gdy nasycony roztwór jest ostrożnie schładzany. Ta zmiana warunków oznacza, że stężenie jest faktycznie wyższe niż punkt nasycenia, roztwór został przesycony..
Można to wykorzystać w procesie rekrystalizacji do oczyszczenia substancji chemicznej: rozpuszcza się do punktu nasycenia w gorącym rozpuszczalniku, a następnie, gdy rozpuszczalnik stygnie i zmniejsza się rozpuszczalność, wytrąca się nadmiar substancji rozpuszczonej.
Zanieczyszczenia, które występują w znacznie niższym stężeniu, nie nasycają rozpuszczalnika i tym samym pozostają rozpuszczone w cieczy.
Bibliografia
- Anne Marie Helmenstine, P. (7 lipca 2016). Definicja i przykłady rozwiązań nasyconych. Pobrane z about: about.com
- Uniwersytet Cambrige. (s.f.). Krzywe rozpuszczalności. Pobrane z dynamicscience.com: dynamicscience.com.au.
- Przykłady roztworu nasyconego. (s.f.). Pobrane z twojego dcitionary: examples.yourdictionary.com.
- , S. (4 czerwca 2014). Roztwory nasycone i przesycone. Pobrane z socratic.org: socratic.org.
- James, N. (s.f.). Rozwiązanie nasycone: definicja i przykłady. Pobrane z study.com: study.com.
- , B. (14 października 2014). Roztwory nasycone i przesycone. Pobrane z socratic.org: socratic.org.
- Krzywe rozpuszczalności. (s.f.). Pobrane z KentChemistry: kentchemistry.com.
- Końcówki nasycenia. (26 czerwca 2014). Pobrane z chemistry libretex: chem.libretexts.org.



Jeszcze bez komentarzy