
Co to są roztwory wodne? (Z przykładami)
Plik roztwory wodne to te rozwiązania, które wykorzystują wodę do rozkładu substancji. Na przykład błoto lub woda z cukrem. Gdy substancja chemiczna rozpuści się w wodzie, jest to oznaczone literą (aq) po nazwie chemicznej.
Substancje hydrofilowe (lubiące wodę) i wiele związków jonowych rozpuszcza się lub dysocjuje w wodzie. Na przykład, gdy sól kuchenna lub chlorek sodu rozpuszcza się w wodzie, dysocjuje na jony, tworząc Na + (aq) i Cl- (aq).

Substancje hydrofobowe (obawiające się wody) na ogół nie rozpuszczają się w wodzie ani nie tworzą roztworów wodnych. Na przykład mieszanie oleju i wody nie prowadzi do rozpuszczenia ani dysocjacji.
Wiele związków organicznych ma właściwości hydrofobowe. Nieelektrolity mogą rozpuszczać się w wodzie, ale nie dysocjują na jony i zachowują swoją integralność jako cząsteczki. Przykłady nieelektrolitów obejmują cukier, glicerol, mocznik i metylosulfonylometan (MSM).
Właściwości roztworów wodnych
Wodne roztwory często przewodzą prąd. Roztwory zawierające mocne elektrolity są zazwyczaj dobrymi przewodnikami elektrycznymi (np. Woda morska), podczas gdy roztwory zawierające słabe elektrolity są zazwyczaj słabymi przewodnikami (np. Woda wodociągowa).
Powodem jest to, że silne elektrolity dysocjują całkowicie na jony w wodzie, podczas gdy słabe elektrolity dysocjują niecałkowicie..
Gdy reakcje chemiczne między gatunkami zachodzą w roztworze wodnym, są to zwykle reakcje podwójnego wypierania (zwane również metatezą lub podwójnym podstawieniem)..
W tego typu reakcji kation w jednym odczynniku zastępuje kation w drugim odczynniku, zwykle tworząc wiązanie jonowe. Innym sposobem myślenia jest to, że reaktywne jony „zmieniają partnerów”.
W wyniku reakcji w roztworze wodnym mogą powstać produkty rozpuszczalne w wodzie lub wytrącony osad..
Osad to związek o niskiej rozpuszczalności, który często wypada z roztworu w postaci ciała stałego..
Terminy kwas, zasada i pH odnoszą się tylko do roztworów wodnych. Na przykład można zmierzyć pH soku z cytryny lub octu (dwa roztwory wodne) i są to słabe kwasy, ale nie można uzyskać żadnych znaczących informacji z testu oleju roślinnego za pomocą papierka pH..
Dlaczego niektóre ciała stałe rozpuszczają się w wodzie?
Cukier, którego używamy do słodzenia kawy lub herbaty, jest cząsteczkową substancją stałą, w której poszczególne cząsteczki są utrzymywane razem przez stosunkowo słabe siły międzycząsteczkowe..
Kiedy cukier rozpuszcza się w wodzie, słabe wiązania między poszczególnymi cząsteczkami sacharozy są zrywane, a te cząsteczki C12H22O11 są uwalniane do roztworu..
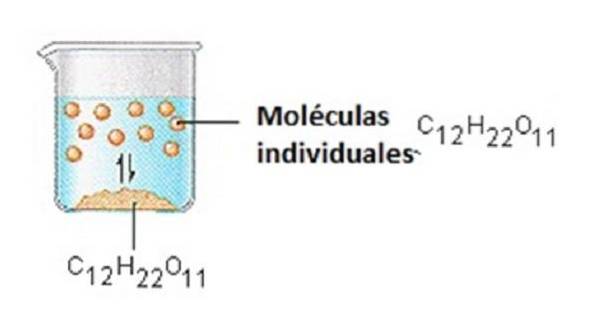
Zerwanie wiązań między cząsteczkami C12H22O11 w sacharozie wymaga energii. Zerwanie wiązań wodorowych w wodzie wymaga również energii, które muszą zostać przerwane, aby wprowadzić jedną z tych cząsteczek sacharozy do roztworu..
Cukier rozpuszcza się w wodzie, ponieważ energia jest uwalniana, gdy lekko polarne cząsteczki sacharozy tworzą międzycząsteczkowe wiązania z polarnymi cząsteczkami wody..
Słabe wiązania, które tworzą się między substancją rozpuszczoną a rozpuszczalnikiem, kompensują energię wymaganą do zmiany struktury zarówno czystej substancji rozpuszczonej, jak i rozpuszczalnika..
W przypadku cukru i wody proces ten przebiega tak dobrze, że w jednym litrze wody można rozpuścić nawet 1800 gramów sacharozy..
Jonowe ciała stałe (lub sole) zawierają jony dodatnie i ujemne, które są utrzymywane razem dzięki dużej sile przyciągania między cząstkami o przeciwnych ładunkach.
Kiedy jedna z tych ciał stałych rozpuszcza się w wodzie, jony tworzące substancję stałą są uwalniane do roztworu, gdzie łączą się z cząsteczkami polarnego rozpuszczalnika..
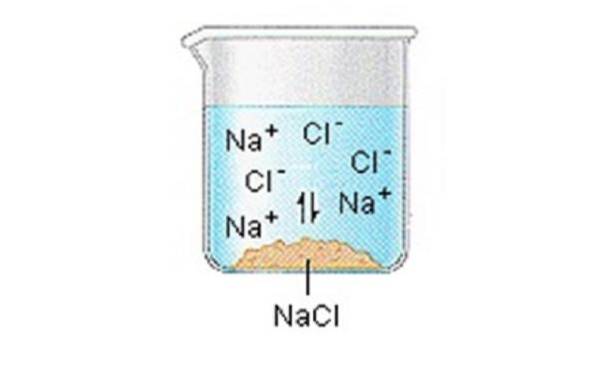
NaCl (s) ”Na + (aq) + Cl- (aq)
Generalnie można założyć, że rozpuszczone w wodzie sole dysocjują na jony..
Związki jonowe rozpuszczają się w wodzie, jeśli energia uwalniana podczas interakcji jonów z cząsteczkami wody przeważa nad energią potrzebną do zerwania wiązań jonowych w ciele stałym i energią wymaganą do oddzielenia cząsteczek wody, aby jony mogły zostać wprowadzone do roztworu.
Zasady rozpuszczalności
W zależności od rozpuszczalności substancji rozpuszczonej istnieją trzy możliwe wyniki:
1) Jeżeli roztwór ma mniej substancji rozpuszczonej niż maksymalna ilość, jaką jest w stanie rozpuścić (jego rozpuszczalność), jest to roztwór rozcieńczony;
2) Jeśli ilość substancji rozpuszczonej jest dokładnie taka sama jak jej rozpuszczalność, jest ona nasycona;
3) Jeśli jest więcej substancji rozpuszczonej niż jest w stanie się rozpuścić, nadmiar substancji rozpuszczonej oddziela się od roztworu.
Jeśli ten proces separacji obejmuje krystalizację, tworzy osad. Wytrącanie zmniejsza stężenie substancji rozpuszczonej do nasycenia w celu zwiększenia stabilności roztworu..
Poniżej przedstawiono zasady rozpuszczalności dla zwykłych jonowych ciał stałych. Jeśli dwie reguły wydają się być ze sobą sprzeczne, pierwszeństwo ma ta poprzednia.
1- Sole zawierające pierwiastki z grupy I (Li+, Na+, K.+, Cs+, Rb+) są rozpuszczalne. Od tej reguły jest kilka wyjątków. Sole zawierające jon amonowy (NH4+) są również rozpuszczalne.
2- Sole zawierające azotany (NO3-) są ogólnie rozpuszczalne.
3- Sole, które zawierają Cl -, Br - lub I - są na ogół rozpuszczalne. Ważnymi wyjątkami od tej reguły są sole halogenkowe Ag+, Pb2+ i (Hg2)dwa+. Zatem AgCl, PbBrdwa i HgdwaCldwa są nierozpuszczalne.
4- Większość soli srebra jest nierozpuszczalna. AgNO3 i Ag (C.dwaH.3LUBdwa) są popularnymi rozpuszczalnymi solami srebra; Praktycznie wszystkie inne są nierozwiązywalne.
5- Większość soli siarczanowych jest rozpuszczalna. Ważnymi wyjątkami od tej reguły są CaSO4, Baso4, PbSO4, AgdwaSO4 i SrSO4.
6- Większość soli wodorotlenkowych jest tylko słabo rozpuszczalna. Sole wodorotlenkowe pierwiastków z grupy I są rozpuszczalne. Sole wodorotlenkowe pierwiastków z grupy II (Ca, Sr i Ba) są słabo rozpuszczalne.
Sole wodorotlenkowe metali przejściowych i Al3 + są nierozpuszczalne. Zatem Fe (OH)3, Al (OH)3, Co (OH)dwa nie są rozpuszczalne.
7- Większość siarczków metali przejściowych jest wysoce nierozpuszczalna, w tym CdS, FeS, ZnS i AgdwaS. Arsen, antymon, bizmut i siarczki ołowiu są również nierozpuszczalne.
8- Węglany są często nierozpuszczalne. Węglany grupy II (CaCO3, SrCO3 i BaCO3) są nierozpuszczalne, podobnie jak FeCO3 i PbCO3.
9- Chromiany są często nierozpuszczalne. Przykłady obejmują PbCrO4 i BaCrO4.
10- Fosforany, takie jak Ca3(PO4)dwa i Ag3PO4 są często nierozpuszczalne.
11- Fluorki, takie jak BaFdwa, MgFdwa i PbFdwa są często nierozpuszczalne.
Przykłady rozpuszczalności w roztworach wodnych
Cola, słona woda, deszcz, roztwory kwaśne, roztwory zasad i roztwory soli to przykłady roztworów wodnych. Mając wodny roztwór, można wywołać osad przez reakcje strącania.
Reakcje strącania są czasami nazywane reakcjami „podwójnego wypierania”. Aby określić, czy po zmieszaniu wodnych roztworów dwóch związków powstanie osad:
- Zapisz wszystkie jony w roztworze.
- Połącz je (kation i anion), aby uzyskać wszystkie potencjalne osady.
- Użyj reguł rozpuszczalności, aby określić, która kombinacja (jeśli w ogóle) jest nierozpuszczalna i będzie się wytrącać.
Przykład 1: Co się dzieje, gdy Ba (NIE3)dwa (aq) i NadwaWSPÓŁ3 (aq)?
Jony obecne w roztworze: Badwa+, NIE3-, Na+, WSPÓŁ3dwa-
Potencjalne osady: BaCO3, NaNO3
Zasady rozpuszczalności: BaCO3 jest nierozpuszczalny (zasada 5), NaNO3 jest rozpuszczalny (zasada 1).
Kompletne równanie chemiczne:
Kąpiel3)dwa(aq) + NadwaWSPÓŁ3(aq) ”BaCO3(s) + 2NaNO3 (aq)
Równanie jonowe netto:
Badwa+(aq) + WSPÓŁ3dwa-(aq) „BaCO3 (s)
Przykład 2: Co się dzieje, gdy Pb (NIE3)dwa (aq) i NH4I (aq)?
Jony obecne w roztworze: Pbdwa+, NIE3-, NH4+, ja-
Potencjalne wytrącenia: PbIdwa, NH4NIE3
Zasady rozpuszczalności: PbIdwa jest nierozpuszczalny (reguła 3), NH4NIE3 jest rozpuszczalny (zasada 1).
Pełne równanie chemiczne: Pb (NO3)2 (aq) + 2NH4ja(aq) „PbI2 (s) + 2NH4NIE3 (aq)
Równanie jonowe netto: Pbdwa+(aq) + 2I-(aq) „PbI2 (s).
Bibliografia
- Anne Marie Helmenstine. (10 maja 2017). Definicja wodna (roztwór wodny). Odzyskany z thinkco.com.
- Anne Marie Helmenstine. (14 maja 2017). Definicja roztworu wodnego w chemii. Odzyskany z thinkco.com.
- Antoinette Mursa, K. W. (14 maja 2017). Zasady rozpuszczalności. Odzyskany z chem.libretexts.org.
- Roztwory wodne. (S.F.). Odzyskany z saylordotorg.github.io.
- Berkey, M. (11 listopada 2011). Roztwory wodne: definicja i przykłady. Odzyskany z youtube.com.
- Reakcje w roztworze wodnym. (S.F.). Odzyskany z chemistry.bd.psu.edu.
- Reid, D. (S.F.). Roztwór wodny: definicja, reakcja i przykład. Odzyskany z study.com.
- Rozpuszczalność. (S.F.). Odzyskany z chemed.chem.purdue.edu.
Jeszcze bez komentarzy