
Co to są zdegenerowane orbitale?
Plik zdegenerowane orbitale to wszyscy ci, którzy są na tym samym poziomie energii. Zgodnie z tą definicją muszą mieć tę samą główną liczbę kwantową n. Zatem orbitale 2s i 2p są zdegenerowane, ponieważ należą do poziomu energii 2. Wiadomo jednak, że ich funkcje fali kątowej i radialnej są różne.
Jako wartości n, elektrony zaczynają zajmować inne podpoziomy energii, takie jak orbitale d i f. Każdy z tych orbitali ma swoje własne cechy, które na pierwszy rzut oka można zobaczyć w ich kanciastych kształtach; Są to figury kuliste (s), hantle (p), koniczyna (d) i kuliste (f).
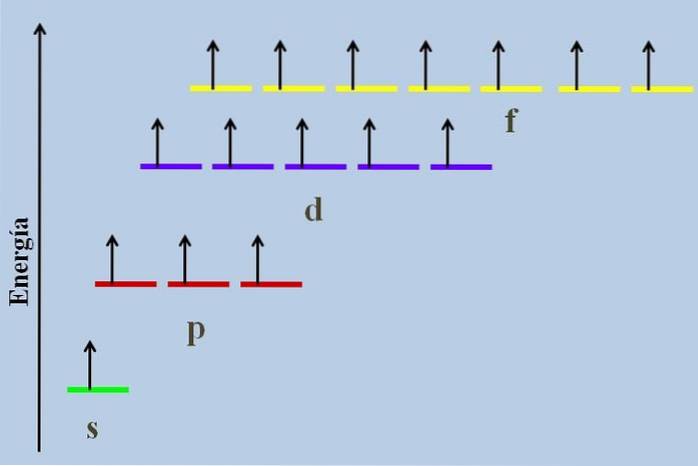
Między nimi jest różnica energetyczna, mimo że należą do tego samego poziomu n.
Na przykład powyższy obrazek przedstawia schemat energetyczny z orbitali zajmowanych przez niesparowane elektrony (przypadek nienormalny). Można zauważyć, że ze wszystkich najbardziej stabilnych (o najniższej energii) jest orbital ns (1s, 2s, ...), natomiast nf jest najbardziej niestabilny (ten o największej energii).
Indeks artykułów
- 1 Zdegenerowane orbitale izolowanego atomu
- 1.1 Orbitale s
- 1.2 Orbitale d
- 1.3 Orbitale f
- 2 zdegenerowane orbitale hybrydowe
- 3 Odnośniki
Zdegenerowane orbitale izolowanego atomu
Zdegenerowane orbitale o tej samej wartości n, są na tej samej linii w schemacie energetycznym. Z tego powodu trzy czerwone paski, które symbolizują orbitale p, znajdują się na tej samej linii; podobnie jak fioletowe i żółte paski.
Schemat na obrazie narusza zasadę Hunda: orbitale o wyższej energii są wypełnione elektronami bez łączenia ich w pary najpierw w orbitale o niższej energii. Gdy elektrony łączą się w pary, orbital traci energię i wywiera większe odpychanie elektrostatyczne na niesparowane elektrony innych orbitali..
Jednak takie efekty nie są uwzględniane na wielu diagramach energetycznych. Jeśli tak, i przestrzegając reguły Hunda bez całkowitego wypełnienia orbitali d, byłoby widać, że przestają się degenerować.
Jak wspomniano wcześniej, każdy orbital ma swoją własną charakterystykę. Izolowany atom o konfiguracji elektronicznej ma elektrony ułożone na określonej liczbie orbitali, aby je pomieścić. Za zdegenerowanych można uznać tylko osoby o równej energii.
Orbitale s
Trzy czerwone paski zdegenerowanych orbitali p na obrazie wskazują, że oba px, pY I pz posiadają tę samą energię. W każdym z nich znajduje się niesparowany elektron, opisany czterema liczbami kwantowymi (n, l, ml Y SM), podczas gdy pierwsze trzy opisują orbitale.
Jedyną różnicą między nimi jest moment magnetyczny ml, który rysuje ścieżkę px na osi x, sY na osi Y i sz na osi z. Wszystkie trzy są takie same, ale różnią się tylko orientacją przestrzenną. Z tego powodu zawsze są narysowane wyrównane w energii, to znaczy zdegenerowane.
Ponieważ są takie same, izolowany atom azotu (o konfiguracji 1sdwa2sdwa2 P3) musi utrzymywać zdegenerowane trzy orbitale p. Jednak scenariusz energetyczny zmienia się gwałtownie, jeśli weźmie się pod uwagę atom N w cząsteczce lub związku chemicznym..
Dlaczego? Bo chociaż sx, pY I pz mają taką samą energię, może się to różnić w każdym z nich, jeśli mają różne środowiska chemiczne; to znaczy, jeśli wiążą się z różnymi atomami.
Orbitale d
Istnieje pięć fioletowych pasków oznaczających orbitale d. W izolowanym atomie, nawet jeśli mają one sparowane elektrony, te pięć orbitali uważa się za zdegenerowane. Jednak w przeciwieństwie do orbitali p, tym razem istnieje wyraźna różnica w ich kształtach kątowych.
Dlatego jego elektrony podróżują w kosmosie w różnych kierunkach, od jednej orbity do drugiej. To powoduje, zgodnie z teoria pola krystalicznego, że minimalne zakłócenie powoduje a rozszczepienie energii orbitali; to znaczy, że pięć fioletowych pasków rozdziela się, pozostawiając między nimi lukę energetyczną:
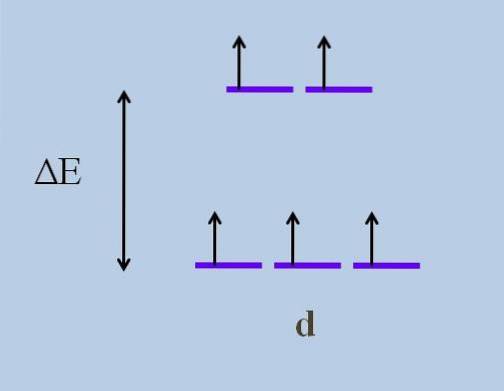
Jakie są górne orbitale, a jakie dolne? Te powyżej są symbolizowane jako isol, i te poniżej t2 g. Zwróć uwagę, jak początkowo wszystkie fioletowe paski były wyrównane, a teraz powstał zestaw dwóch orbitali isol bardziej energiczny niż inny zestaw trzech orbitali t2 g.
Teoria ta pozwala nam wyjaśnić przejścia d-d, którym przypisuje się wiele kolorów obserwowanych w związkach metali przejściowych (Cr, Mn, Fe itp.). A jaka jest przyczyna tych zakłóceń elektronicznych? Do koordynacyjnych interakcji centrum metalu z innymi cząsteczkami nazywamy ligandy.
Orbitale f
A w przypadku orbitali f, filcowych żółtych pasków, sytuacja staje się jeszcze bardziej skomplikowana. Ich kierunki przestrzenne bardzo się między nimi różnią, a wyświetlanie ich powiązań staje się zbyt złożone.
W rzeczywistości uważa się, że orbitale f są tak osłonięte wewnętrznie, że nie „uczestniczą w znacznym stopniu” w tworzeniu wiązań..
Kiedy izolowany atom z orbitaliami f otacza się innymi atomami, zaczynają się i rozwijają interakcje (utrata degeneracji):
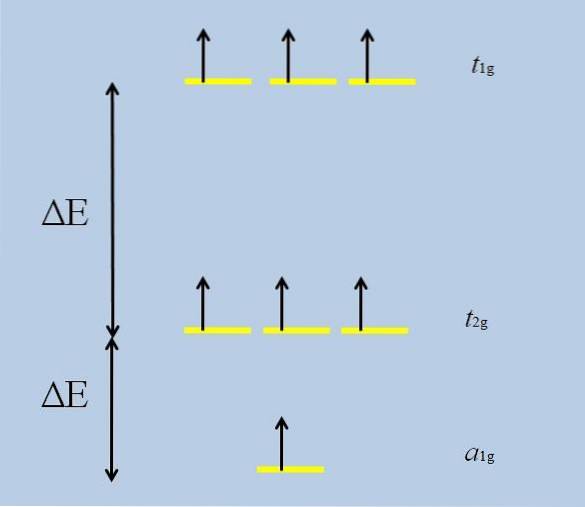
Zwróć uwagę, że teraz żółte paski tworzą trzy zestawy: t1g, t2 g Y do1g, i że nie są już zdegenerowani.
Zdegenerowane orbitale hybrydowe
Zaobserwowano, że orbitale mogą się rozwinąć i utracić zwyrodnienie. Jednakże, chociaż wyjaśnia to przejścia elektronowe, blednie w wyjaśnianiu, jak i dlaczego istnieją różne geometrie molekularne. Tutaj wkraczają orbitale hybrydowe..
Jakie są jego główne cechy? Że są zdegenerowani. W ten sposób powstają z mieszaniny znaków orbitali s, p, d i f, tworząc zdegenerowane hybrydy.
Na przykład trzy orbitale p mieszają się z jednym s, dając cztery orbitale sp3. Wszystkie orbitale sp3 są zdegenerowane i dlatego mają tę samą energię.
Jeśli dodatkowo dwa d orbitale zostaną zmieszane z czterema sp3, otrzymasz sześć orbitali sp3redwa.
Jak wyjaśniają geometrie molekularne? Ponieważ jest ich sześć o równych energiach, muszą one być zatem zorientowane symetrycznie w przestrzeni, aby wygenerować równe środowiska chemiczne (na przykład w związku MF6).
Kiedy to robią, powstaje ośmiościan koordynacyjny, który jest równy ośmiościennej geometrii wokół środka (M).
Jednak geometrie są często zniekształcone, co oznacza, że nawet orbitale hybrydowe nie są tak naprawdę całkowicie zdegenerowane. Dlatego też, podsumowując, zdegenerowane orbitale istnieją tylko w izolowanych atomach lub w wysoce symetrycznych środowiskach..
Bibliografia
- Słownik Chemicool. (2017). Definicja zdegenerowanego. Źródło: chemicool.com
- SparkNotes LLC. (2018). Atomy i orbitale atomowe. Odzyskany z: sparknotes.com
- Czysta chemia. (s.f.). Elektroniczna Konfiguracja. Odzyskany z: es-puraquimica.weebly.com
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning.
- Moreno R. Esparza. (2009). Kurs chemii koordynacyjnej: Pola i orbitale. [PDF]. Odzyskany z: depa.fquim.unam.mx
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.



Jeszcze bez komentarzy