
Typy i przykłady reakcji podwójnego podstawienia

Plik reakcja podwójnego podstawienia, podwójne przemieszczenie lub metateeza to taka, w której zachodzi podwójna wymiana jonowa między dwoma związkami, bez utleniania lub redukcji żadnego z nich. Stanowi jedną z najbardziej elementarnych reakcji chemicznych.
Nowe wiązania są tworzone przez duże elektrostatyczne siły przyciągania między jonami. Podobnie reakcja sprzyja tworzeniu się najbardziej stabilnych gatunków, głównie cząsteczki wody. Poniższy obraz ilustruje ogólne równanie chemiczne reakcji podwójnego podstawienia..
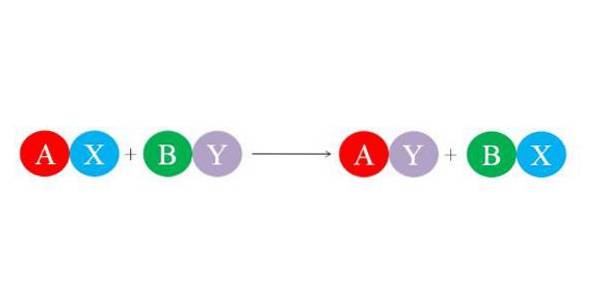
Początkowe związki AX i BY reagują wymieniając „swoich partnerów”, tworząc w ten sposób dwa nowe związki: AY i BX. Ta reakcja zachodzi wtedy i tylko wtedy, gdy A i Y są bardziej powiązane niż A i B lub jeśli wiązania BX są bardziej stabilne niż wiązania BY. Ponieważ reakcja jest prostą wymianą jonową, ani jon nie zyskuje, ani nie traci elektronów (reakcja redoks).
Tak więc, jeśli A jest kationem z ładunkiem +1 w związku AX, będzie miał taki sam ładunek +1 w związku AY. To samo dotyczy pozostałych „liter”. Ten typ reakcji wspomaga reakcje kwasowo-zasadowe i tworzenie osadów..
Indeks artykułów
- 1 Rodzaje
- 1.1 Neutralizacja
- 1.2 Opady
- 2 Przykłady
- 2.1 Przykład 1
- 2.2 Przykład 2
- 2.3 Przykład 3
- 2.4 Przykład 4
- 2.5 Przykład 5
- 2.6 Przykład 6
- 2.7 Przykład 7
- 2.8 Przykład 8
- 3 Odnośniki
Rodzaje
Neutralizacja
Silny kwas reaguje z mocną zasadą, tworząc rozpuszczalne sole i wodę. Kiedy jeden z nich - kwas lub zasada - jest słaby, wytworzona sól nie jest całkowicie zjonizowana; to znaczy w środowisku wodnym zdolnym do hydrolizy. Podobnie kwas lub zasadę można zneutralizować solą..
Powyższe można ponownie przedstawić za pomocą równania chemicznego z literami AXBY. Jednak ponieważ kwasowość Brønsteda jest wskazywana tylko przez jony H.+ i OH-, Te następnie przedstawiają litery A i Y:
HX + BOH => HOH + BX
To równanie chemiczne odpowiada neutralizacji, która jest po prostu reakcją między kwasem HX i zasadą BOH w celu wytworzenia HOH (HdwaO) i sól BX, która może być rozpuszczalna w wodzie lub nie.
Jego szkielet może się różnić w zależności od współczynników stechiometrycznych lub natury kwasu (jeśli jest organiczny lub nieorganiczny).
Opad atmosferyczny
W tego typu reakcji jeden z produktów jest nierozpuszczalny w środowisku, na ogół wodnym i wytrąca się (ciało stałe osadza się z reszty roztworu).
Schemat jest następujący: miesza się dwa rozpuszczalne związki, AX i BY, i wytrąca się jeden z produktów, AY lub BX, co będzie zależało od zasad rozpuszczalności:
AX + BY => AY (s) + BX
AX + BY => AY + BX (s)
W przypadku, gdy zarówno AY, jak i BX są nierozpuszczalne w wodzie, para jonów, które wykazują najsilniejsze oddziaływania elektrostatyczne, wytrąci się, co można ilościowo odzwierciedlić w ich wartościach stałych rozpuszczalności (Kps).
Jednak w większości reakcji strącania jedna sól jest rozpuszczalna, a druga wytrąca się. Obie reakcje - neutralizacja i strącanie - mogą zachodzić w tej samej mieszaninie substancji.
Przykłady
Przykład 1
HCl (aq) + NaOH (aq) => HdwaO (l) + NaCl (aq)
Co to za reakcja? Kwas solny reaguje z wodorotlenkiem sodu, tworząc w konsekwencji wodę i chlorek sodu. Ze względu na to, że NaCl jest bardzo dobrze rozpuszczalny w środowisku wodnym, a także powstała cząsteczka wody, reakcją z przykładu 1 jest zobojętnianie.
Przykład 2
Znaczek3)dwa(ac) + NadwaS (ac) => CuS (s) + 2NaNO3(ac)
Żaden jon H nie jest obecny w tej reakcji+ ani OH-, ani też cząsteczki wody nie obserwuje się po prawej stronie równania chemicznego.
Azotan miedzi (II) lub azotan miedziowy wymienia jony z siarczkiem sodu. Siarczek miedzi jest nierozpuszczalny, wytrąca się w przeciwieństwie do azotanu sodu, rozpuszczalnej soli.
Roztwór Cu (NIE3)dwa jest niebieskawy, podczas gdy NadwaS jest żółtawy. Kiedy oba są zmieszane, kolory znikają i wytrąca się CuS, który jest czarnawym ciałem stałym..
Przykład 3
CH3COOH (aq) + NaOH (aq) => CH3COONa (ac) + H.dwaO (l)
To jest kolejna reakcja neutralizacji. Kwas octowy reaguje z wodorotlenkiem sodu, tworząc sól octanu sodu i cząsteczkę wody.
W przeciwieństwie do przykładu 1, octan sodu nie jest solą w pełni zjonizowaną, ponieważ anion jest hydrolizowany:
CH3GRUCHAĆ-(ac) + HdwaO (l) <=> CH3COOH (aq) + OH-(ac)
Przykład 4
2HI (ac) + CaCO3(s) => H.dwaWSPÓŁ3(ac) + CaIdwa(ac)
W tej reakcji - która chociaż nie wydaje się być neutralizacją - kwas jodowodorowy całkowicie reaguje z wapieniem, tworząc kwas węglowy i jodek wapnia. Ponadto wydzielanie się ciepła (reakcja egzotermiczna) powoduje rozkład kwasu węglowego na dwutlenek węgla i wodę:
H.dwaWSPÓŁ3(ac) => COdwa(g) + HdwaO (l)
Ogólna reakcja jest następująca:
2HI (ac) + CaCO3(s) => COdwa(g) + HdwaO (l) + CaIdwa(ac)
Podobnie węglan wapnia, sól zasadowa, neutralizuje kwas jodowodorowy.
Przykład 5
AgNO3(aq) + NaCl (aq) => AgCl (s) + NaNO3(ac)
Azotan srebra wymienia jony z chlorkiem sodu, tworząc w ten sposób nierozpuszczalną sól, chlorek srebra (białawy osad) i azotan sodu..
Przykład 6
2H3PO4(ac) + 3Ca (OH)dwa(ac) => 6HdwaO (l) + Ca3(PO4)dwa(s)
Kwas fosforowy jest neutralizowany wodorotlenkiem wapnia, tworząc w konsekwencji nierozpuszczalną sól fosforanu wapnia i sześć moli cząsteczek wody..
Jest to przykład podwójnej reakcji podstawienia obu typów: zobojętnienia kwasu i wytrącenia nierozpuszczalnej soli..
Przykład 7
K.dwaS (ac) + MgSO4(ac) => K.dwapołudniowy zachód4(ac) + MgS (s)
Siarczek potasu reaguje z siarczanem magnezu, gromadząc jony S w roztworzedwa- i Mgdwa+ z utworzeniem nierozpuszczalnej soli siarczku magnezu i rozpuszczalnej soli siarczanu potasu.
Przykład 8
NadwaS (aq) + HCl (aq) → NaCl (aq) + HdwaS (g)
Siarczek sodu neutralizuje kwas solny, wytwarzając chlorek sodu i siarkowodór.
W tej reakcji nie powstaje woda (w przeciwieństwie do większości typowych neutralizacji), ale nieelektrolityczna cząsteczka siarkowodoru, której zapach zgniłych jaj jest bardzo nieprzyjemny. HdwaS ucieka z roztworu w postaci gazowej, a reszta gatunków pozostaje rozpuszczona.
Bibliografia
- Whitten, Davis, Peck & Stanley. Chemia. (8th ed.). CENGAGE Learning, s. 150–155.
- Quimicas.net (2018). Przykłady reakcji podwójnego podstawienia. Pobrano 28 maja 2018 r. Z: quimicas.net
- Reakcje metatezy. Pobrane 28 maja 2018 r. Z: science.uwaterloo.ca
- Khan academy. (2018). Reakcje podwójnej wymiany. Pobrane 28 maja 2018 r. Z: khanacademy.org
- Helmenstine, dr Anne Marie (8 maja 2016). Definicja reakcji podwójnej zamiany. Pobrane 28 maja 2018 r. Z: thinkco.com



Jeszcze bez komentarzy