
Charakterystyka, równania i przykłady reakcji endotermicznych

ZA reakcja endotermiczna To taki, który musi zaabsorbować energię w postaci ciepła lub promieniowania z otoczenia. Generalnie, choć nie zawsze, można je rozpoznać po spadku temperatury w ich otoczeniu; lub wręcz przeciwnie, potrzebują źródła ciepła, takiego jak otrzymywane przez płonący płomień.
Absorpcja energii lub ciepła jest tym, co łączy wszystkie reakcje endotermiczne; ich charakter, jak również związane z nimi przemiany, są bardzo zróżnicowane. Ile ciepła powinny wchłonąć? Odpowiedź zależy od jego termodynamiki: temperatury, w której reakcja zachodzi spontanicznie.

Na przykład jedną z najbardziej charakterystycznych reakcji endotermicznych jest zmiana stanu z lodu na wodę w stanie ciekłym. Lód musi absorbować ciepło, aż jego temperatura osiągnie około 0ºC; w tej temperaturze jego topnienie staje się samorzutne, a lód wchłania się, aż do całkowitego stopienia.
W gorących przestrzeniach, takich jak brzegi plaży, temperatury są wyższe i dlatego lód szybciej pochłania ciepło; to znaczy topi się szybciej. Przykładem niepożądanej reakcji endotermicznej jest topnienie lodowców.
Dlaczego tak się dzieje? Dlaczego lód nie może wyglądać jak gorąca substancja stała? Odpowiedź leży w średniej energii kinetycznej cząsteczek wody w obu stanach oraz w tym, jak oddziałują one ze sobą poprzez wiązania wodorowe..
W wodzie ciekłej jej cząsteczki mają większą swobodę ruchu niż w lodzie, gdzie w swoich kryształach drgają stacjonarnie. Aby się poruszać, cząsteczki muszą absorbować energię w taki sposób, aby ich wibracje przerywały silne kierunkowe wiązania wodorowe w lodzie..
Z tego powodu lód topi się absorbując ciepło. Aby istniał „gorący lód”, wiązania wodorowe musiałyby być nienormalnie mocne, aby stopiły się w temperaturze znacznie powyżej 0ºC..
Indeks artykułów
- 1 Charakterystyka reakcji endotermicznej
- 1,1 ΔH> 0
- 1.2 Chłodzą otoczenie
- 2 Równania
- 3 Przykłady typowych reakcji endotermicznych
- 3.1 Odparowanie suchego lodu
- 3.2 Pieczenie chleba lub gotowanie jedzenia
- 3.3 Opalanie się
- 3.4 Reakcja tworzenia się azotu atmosferycznego i ozonu
- 3.5 Elektroliza wody
- 3.6 Fotosynteza
- 3.7 Roztwory niektórych soli
- 3.8 Rozkład termiczny
- 3.9 Chlorek amonu w wodzie
- 3.10 Triosiarczan sodu
- 3.11 Silniki samochodowe
- 3.12 Gotowanie cieczy
- 3.13 Gotowanie jajka
- 3.14 Gotowanie żywności
- 3.15 Podgrzewanie potraw w kuchence mikrofalowej
- 3.16 Formowanie szkła
- 3.17 Spożycie świecy
- 3.18 Czyszczenie gorącą wodą
- 3.19 Sterylizacja termiczna żywności i innych przedmiotów
- 3.20 Zwalczanie infekcji z gorączką
- 3.21 Odparowanie wody
- 4 Odnośniki
Charakterystyka reakcji endotermicznej
Zmiana stanu nie jest właściwie reakcją chemiczną; jednak dzieje się to samo: produkt (woda w stanie ciekłym) ma wyższą energię niż reagent (lód). Jest to główna cecha reakcji lub procesu endotermicznego: produkty są bardziej energetyczne niż reagenty.
Chociaż jest to prawdą, nie oznacza to, że produkty muszą koniecznie być niestabilne. W takim przypadku endotermiczna reakcja nie jest już spontaniczna we wszystkich warunkach temperatury i ciśnienia..
Rozważmy następujące równanie chemiczne:
A + Q => B
Gdzie Q oznacza ciepło, zwykle wyrażane w dżulach (J) lub kaloriach (cal). Ponieważ A pochłania ciepło Q, aby przekształcić się w B, mówi się, że jest to reakcja endotermiczna. Zatem B ma więcej energii niż A i musi pochłonąć wystarczającą ilość energii, aby osiągnąć swoją transformację.
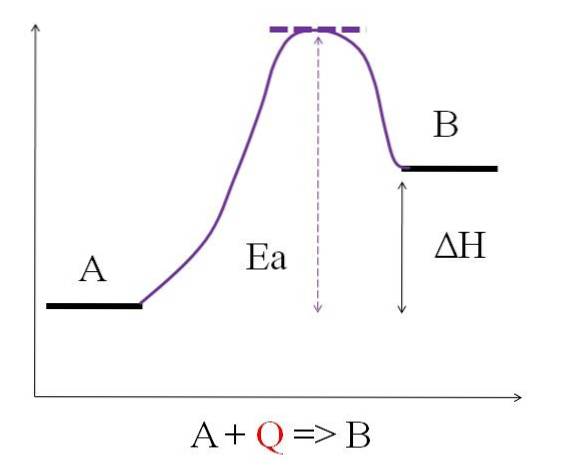
Jak widać na powyższym diagramie, A ma mniej energii niż B. Ilość ciepła Q pochłoniętego przez A jest taka, że pokonuje energię aktywacji (energię potrzebną do osiągnięcia fioletowego piku z kropkowanym dachem). Różnica energii między A i B jest znana jako entalpia reakcji, ΔH.
ΔH> 0
Wszystkie reakcje endotermiczne mają wspólny powyższy schemat, ponieważ produkty są bardziej energetyczne niż reagenty. Dlatego różnica energii między nimi, ΔH, jest zawsze dodatnia (H.Produkt-H.Odczynnik > 0). Ponieważ jest to prawdą, musi nastąpić absorpcja ciepła lub energii z otoczenia, aby zaspokoić to zapotrzebowanie na energię..
A jak interpretuje się takie wyrażenia? W reakcji chemicznej wiązania są zawsze rozrywane, aby utworzyć nowe. Aby je złamać, konieczna jest absorpcja energii; to znaczy jest to krok endotermiczny. Tymczasem tworzenie wiązań implikuje stabilność, więc jest to krok egzotermiczny..
Gdy utworzone wiązania nie zapewniają stabilności porównywalnej z ilością energii potrzebnej do zerwania starych wiązań, jest to reakcja endotermiczna. Dlatego potrzebna jest dodatkowa energia, aby promować zrywanie najbardziej stabilnych wiązań w reagentach..
Z drugiej strony, w reakcjach egzotermicznych jest odwrotnie: uwalniane jest ciepło, a ΔH jest < 1 (negativo). Aquí los productos son más estables que los reactivos, y el diagrama entre A y B cambia de forma; ahora B se ubica por debajo de A, y la energía de activación es menor.
Chłodzą otoczenie
Chociaż nie dotyczy to wszystkich reakcji endotermicznych, kilka z nich powoduje obniżenie temperatury otoczenia. Dzieje się tak, ponieważ pochłonięte ciepło skądś pochodzi. W konsekwencji, jeśli konwersja A i B byłaby przeprowadzana wewnątrz pojemnika, zostałby on schłodzony.
Im bardziej endotermiczna reakcja, tym chłodniejszy będzie pojemnik i jego otoczenie. W rzeczywistości niektóre reakcje mogą nawet tworzyć cienką warstwę lodu, tak jakby wyszły z lodówki..
Są jednak tego typu reakcje, które nie chłodzą otoczenia. Dlaczego? Ponieważ otaczające ciepło jest niewystarczające; to znaczy, nie dostarcza niezbędnego Q (J, cal), które jest zapisane w równaniach chemicznych. Dlatego dzieje się tak, gdy wchodzi ogień lub promieniowanie ultrafioletowe..
Między tymi dwoma scenariuszami może powstać trochę zamieszania. Z jednej strony ciepło z otoczenia jest wystarczające, aby reakcja przebiegła spontanicznie i obserwuje się chłodzenie; z drugiej strony potrzebne jest więcej ciepła i stosowana jest wydajna metoda ogrzewania. W obu przypadkach dzieje się to samo: energia jest pochłaniana.
Równania
Jakie są odpowiednie równania w reakcji endotermicznej? Jak już wyjaśniono, ΔH musi być dodatnia. Aby to obliczyć, najpierw rozważa się następujące równanie chemiczne:
aA + bB => cC + dD
Gdzie A i B to reagenty, a C i D to produkty. Małe litery (a, b, c i d) to współczynniki stechiometryczne. Aby obliczyć ΔH tej ogólnej reakcji, stosuje się następujące wyrażenie matematyczne:
ΔHProdukty- ΔHOdczynniki = ΔHrxn
Możesz przejść bezpośrednio lub wykonać obliczenia osobno. Dla ΔHProdukty należy obliczyć następującą sumę:
c ΔHfaC + d ΔHfare
Gdzie ΔHfa jest entalpią tworzenia się każdej substancji biorącej udział w reakcji. Zgodnie z konwencją substancje w najbardziej stabilnych formach mają ΔHfa= 0. Na przykład cząsteczki Odwa i Hdwa, lub litego metalu mają ΔHfa= 0.
To samo obliczenie jest teraz wykonywane dla reagentów, ΔHOdczynniki:
a ΔHfaA + b ΔHfab
Ale ponieważ równanie mówi, że ΔHOdczynniki należy odjąć od ΔHProdukty, wtedy powyższą sumę należy pomnożyć przez -1. Więc masz:
c ΔHfaC + d ΔHfaD - (a ΔHfaA + b ΔHfaB)
Jeśli wynik tego obliczenia jest liczbą dodatnią, jest to reakcja endotermiczna. A jeśli wynik testu jest negatywny, jest to reakcja egzotermiczna.
Przykłady typowych reakcji endotermicznych
Odparowanie suchego lodu

Każdy, kto kiedykolwiek widział te białe opary wydobywające się z wózka z lodami, był świadkiem jednego z najczęstszych przykładów endotermicznej „reakcji”.
Poza niektórymi lodami, te opary wydzielane z białych ciał stałych, zwanych suchym lodem, również były częścią scenariuszy tworzenia efektu mgły. Ten suchy lód to nic innego jak stały dwutlenek węgla, który wchłaniając temperaturę i zanim ciśnienie zewnętrzne zacznie sublimować.
Eksperyment dla publiczności dziecięcej polegałby na napełnieniu i zamknięciu torby suchym lodem. Po chwili w końcu nadmuchi się z powodu COdwa gazowy, który generuje pracę lub naciska wewnętrzne ścianki worka na ciśnienie atmosferyczne.
Pieczenie chleba lub gotowanie jedzenia

Pieczenie chleba jest przykładem reakcji chemicznej, ponieważ teraz zachodzą zmiany chemiczne pod wpływem ciepła. Każdy, kto poczuł zapach świeżo upieczonego chleba, wie, że zachodzi reakcja endotermiczna.
Ciasto i wszystkie jego składniki potrzebują ciepła pieca, aby przeprowadzić wszystkie przemiany, niezbędne, aby stać się chlebem i wykazywać jego typowe cechy..
Oprócz pieczywa kuchnia pełna jest przykładów reakcji endotermicznych. Kto gotuje, ma z nimi do czynienia na co dzień. Gotowanie makaronu, zmiękczanie ziaren, podgrzewanie ziaren kukurydzy, gotowanie jajek, przyprawianie mięs, pieczenie ciasta, robienie herbaty, podgrzewanie kanapek; każda z tych czynności jest reakcją endotermiczną.
Opalanie się

Choć może się to wydawać proste i powszechne, kąpiele słoneczne podejmowane przez niektóre gady, takie jak żółwie i krokodyle, należą do kategorii reakcji endotermicznych. Żółwie pochłaniają ciepło słońca, aby regulować temperaturę ciała.
Bez słońca zatrzymują ciepło wody, aby się ogrzać; co kończy się schłodzeniem wody w stawach lub akwariach.
Reakcja tworzenia się azotu atmosferycznego i ozonu

Powietrze składa się głównie z azotu i tlenu. Podczas burz z wyładowaniami elektrycznymi uwalniana jest taka energia, że może zerwać silne wiązania, które utrzymują razem atomy azotu w cząsteczce N.dwa:
Ndwa + LUBdwa + Q => 2NO
Z drugiej strony tlen może absorbować promieniowanie ultrafioletowe i przekształcić się w ozon; alotrop tlenu, który jest bardzo korzystny w stratosferze, ale szkodliwy dla życia na poziomie gruntu. Reakcja jest następująca:
3Odwa + v => 2O3
Gdzie v oznacza promieniowanie ultrafioletowe. Mechanizm tego prostego równania jest bardzo złożony.
Elektroliza wody
Elektroliza wykorzystuje energię elektryczną do rozdzielenia cząsteczki na tworzące ją elementy lub cząsteczki. Na przykład podczas elektrolizy wody powstają dwa gazy: wodór i tlen, każdy w różnych elektrodach:
2HdwaO => 2Hdwa + LUBdwa
Również chlorek sodu może podlegać tej samej reakcji:
2NaCl => 2Na + Cldwa
Na jednej elektrodzie widać tworzenie się metalicznego sodu, a na drugiej zielonkawe bąbelki chloru.
Fotosynteza

Rośliny i drzewa muszą absorbować światło słoneczne jako źródło energii do syntezy swoich biomateriałów. W tym celu wykorzystuje CO jako surowiec.dwa oraz wodę, która w długiej serii etapów jest przekształcana w glukozę i inne cukry. Ponadto powstaje tlen, który jest uwalniany z liści.
Roztwory niektórych soli
Jeśli chlorek sodu zostanie rozpuszczony w wodzie, nie będzie zauważalnej zmiany temperatury zewnętrznej szklanki lub pojemnika..
Niektóre sole, takie jak chlorek wapnia, CaCldwa, podnieść temperaturę wody w wyniku wielkiego uwodnienia jonów Ca.dwa+. Oraz inne sole, takie jak azotan lub chlorek amonu, NH4NIE3 i NH4Cl, obniż temperaturę wody i ochłodź jej otoczenie.
W salach lekcyjnych eksperymenty domowe są zwykle wykonywane przez rozpuszczenie niektórych z tych soli, aby pokazać, czym jest reakcja endotermiczna..
Spadek temperatury wynika z hydratacji jonów NH4+ nie jest to korzystne dla rozpuszczania krystalicznych układów jego soli. W konsekwencji sole absorbują ciepło z wody, aby umożliwić solwatację jonów..
Inna reakcja chemiczna, która jest zwykle bardzo powszechna, aby to wykazać, jest następująca:
Ba (OH)dwa8HdwaO + 2NH4NIE3 => Ba (NIE3)dwa + 2NH3 +10HdwaLUB
Zwróć uwagę na ilość utworzonej wody. Mieszając oba ciała stałe, wodny roztwór Ba (NO3)dwa, pachnie amoniakiem i ze spadkiem temperatury tak, że dosłownie zamarza zewnętrzną powierzchnię pojemnika.
Rozkład termiczny
Jednym z najpowszechniejszych rozkładów termicznych jest wodorowęglan sodu NaHCO3, do produkcji COdwa i woda po podgrzaniu. Wiele ciał stałych, w tym węglany, często rozkłada się, uwalniając COdwa i odpowiedni tlenek. Na przykład rozkład węglanu wapnia wygląda następująco:
Złodziej3 + Q => CaO + COdwa
To samo dzieje się z węglanami magnezu, strontu i baru.
Należy zauważyć, że rozkład termiczny różni się od spalania. W pierwszej nie ma zapłonu ani wydzielania ciepła, podczas gdy w drugiej jest; to znaczy spalanie jest reakcją egzotermiczną, nawet jeśli wymaga początkowego źródła ciepła, aby nastąpiło lub nastąpiło spontanicznie.
Chlorek amonu w wodzie
Gdy niewielka ilość chlorku amonu (NH4Cl) zostanie rozpuszczona w wodzie w probówce, probówka staje się zimniejsza niż poprzednio. Podczas tej reakcji chemicznej ciepło jest pochłaniane z otoczenia.
Triosiarczan sodu
Gdy kryształy tiosiarczanu sodu (NadwaSdwaLUB3.5HdwaO), zwane potocznie czkawką, rozpuszczają się w wodzie, pojawia się efekt chłodzenia.
Silniki samochodowe
Spalanie benzyny lub oleju napędowego w silnikach samochodów osobowych, ciężarowych, traktorów czy autobusów wytwarza energię mechaniczną, która jest wykorzystywana w ruchu tych pojazdów.
Gotowanie płynów
Podgrzewając ciecz, nabiera energii i przechodzi w stan gazowy.
Ugotuj jajko
Pod wpływem ciepła białka jaja ulegają denaturacji, tworząc stałą strukturę, która jest zwykle spożywana..
Gotowanie jedzenia
Ogólnie rzecz biorąc, zawsze podczas gotowania z użyciem ciepła, aby zmienić właściwości żywności, zachodzą reakcje endotermiczne.
Reakcje te powodują, że żywność staje się miękka, tworzy plastyczne masy, między innymi uwalnia zawarte w niej składniki..
Podgrzewanie potraw w kuchence mikrofalowej
Poprzez promieniowanie mikrofalowe cząsteczki wody w pożywieniu pochłaniają energię, zaczynają wibrować i podwyższają temperaturę pożywienia.
Formowanie szkła
Absorpcja ciepła przez szkło uelastycznia spoiny, ułatwiając zmianę kształtu.
Spożycie świecy
Wosk ze świecy topi się, absorbując ciepło z płomienia, zmieniając swój kształt.
Czyszczenie gorącą wodą
Podczas czyszczenia gorącą wodą przedmiotów poplamionych tłuszczem, takich jak garnki lub ubrania, tłuszcz staje się bardziej płynny i łatwiejszy do usunięcia.
Sterylizacja termiczna żywności i innych przedmiotów
Podczas podgrzewania przedmiotów lub żywności zawarte w nich mikroorganizmy również podwyższają swoją temperaturę.
Gdy dostarczane jest dużo ciepła, zachodzą reakcje w komórkach drobnoustrojów. Wiele z tych reakcji, takich jak zrywanie wiązań lub denaturacja białek, kończy się śmiercią mikroorganizmów.
Walcz z infekcjami za pomocą gorączki
Kiedy pojawia się gorączka, dzieje się tak, ponieważ organizm wytwarza ciepło niezbędne do zabicia bakterii i wirusów, które powodują infekcje i generują choroby..
Jeśli wytwarzane ciepło jest duże, a gorączka jest wysoka, wpływa to również na komórki ciała i istnieje ryzyko śmierci.
Odparowanie wody
Kiedy woda paruje i zamienia się w parę, dzieje się tak z powodu ciepła, które odbiera z otoczenia. Gdy energia cieplna jest odbierana przez każdą cząsteczkę wody, jej energia wibracji wzrasta do punktu, w którym może się swobodnie poruszać, tworząc parę..
Bibliografia
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning.
- Wikipedia. (2018). Proces endotermiczny. Odzyskane z: en.wikipedia.org
- Helmenstine, dr Anne Marie (27 grudnia 2018). Przykłady reakcji endotermicznych. Odzyskany z: thinkco.com
- Khan academy. (2019). Endotermiczne vs. reakcje egzotermiczne. Odzyskane z: khanacademy.org
- Serm Murmson. (2019). Co dzieje się na poziomie molekularnym podczas reakcji endotermicznej? Hearst Seattle Media. Odzyskany z: education.seattlepi.com
- QuimiTube. (2013). Obliczanie entalpii reakcji na podstawie entalpii tworzenia. Odzyskany z: quimitube.com
- Quimicas.net (2018). Przykłady reakcji endotermicznej. Wyzdrowiał z:
chemistry.net.



Jeszcze bez komentarzy