
Odkrycie renu, właściwości, budowa, zastosowania
Plik ren Jest to pierwiastek metaliczny, którego symbol chemiczny to Re i znajduje się w grupie 7 układu okresowego, dwa miejsca poniżej manganu. Dzieli z tym i technetem właściwość wykazywania wielu liczb lub stopni utlenienia, od +1 do +7. Tworzy również anion zwany nadrenianem, ReO4-, analogicznie do nadmanganianu, MnO4-.
Ten metal jest jednym z najrzadszych i najbardziej rzadkich w przyrodzie, więc jego cena jest wysoka. Wydobywany jest jako produkt uboczny wydobycia molibdenu i miedzi. Jedną z najważniejszych właściwości renu jest jego wysoka temperatura topnienia, ledwo przewyższana przez węgiel i wolfram, oraz jego wysoka gęstość, dwukrotnie większa niż ołowiu..

Jego odkrycie ma kontrowersyjny i niefortunny wydźwięk. Nazwa „ren” pochodzi od łacińskiego słowa „rhenus”, które oznacza Ren, słynną niemiecką rzekę w pobliżu miejsca, w którym pracowali niemieccy chemicy, którzy wyizolowali i zidentyfikowali ten nowy pierwiastek..
Ren ma wiele zastosowań, wśród których wyróżnia się uszlachetnianie liczby oktanowej benzyny, a także w produkcji nadstopów ogniotrwałych, przeznaczonych do montażu turbin i silników statków lotniczych..
Indeks artykułów
- 1 Odkrycie
- 2 Właściwości renu
- 2.1 Wygląd fizyczny
- 2.2 Masa molowa
- 2.3 Liczba atomowa
- 2.4 Temperatura topnienia
- 2.5 Temperatura wrzenia
- 2.6 Gęstość
- 2.7 Elektroujemność
- 2.8 Energie jonizacji
- 2,9 Molowa pojemność cieplna
- 2.10 Przewodność cieplna
- 2.11 Oporność elektryczna
- 2.12 Twardość Mohsa
- 2.13 Izotopy
- 2.14 Reaktywność
- 3 Struktura i konfiguracja elektroniczna
- 3.1 stopnie utlenienia
- 4 Zastosowania
- 4.1 Benzyna
- 4.2 Nadstopy ogniotrwałe
- 4.3 Włókna wolframowe
- 5 Referencje
Odkrycie
Istnienie dwóch ciężkich pierwiastków o właściwościach chemicznych podobnych do właściwości manganu było już przewidywane od 1869 roku za pomocą układu okresowego pierwiastków rosyjskiego chemika Dmitrija Mendelejewa. Jednak do tego czasu nie było wiadomo, jakie powinny być ich liczby atomowe; i to tutaj w 1913 roku wprowadzono przepowiednię angielskiego fizyka Henry'ego Moseleya.
Według Moseleya te dwa pierwiastki należące do grupy manganu muszą mieć liczby atomowe 43 i 75.
Jednak kilka lat wcześniej japoński chemik Masataka Ogawa odkrył domniemany pierwiastek 43 w próbce mineralnego torianitu. Po ogłoszeniu wyników w 1908 r. Chciał ochrzcić ten pierwiastek imieniem „Niponio”. Niestety, wówczas chemicy udowodnili, że Ogawa nie odkrył pierwiastka 43..
I tak minęły inne lata, kiedy w 1925 r. Trzej niemieccy chemicy: Walter Noddack, Ida Noddack i Otto Berg znaleźli pierwiastek 75 w próbkach minerałów kolumbitu, gadolinitu i molibdenitu. To dało mu imię renu na cześć rzeki Ren w Niemczech (po łacinie `` Rhenus '').
Błąd Masataki Ogawy polegał na tym, że dokonał błędnej identyfikacji pierwiastka: odkrył on ren, a nie pierwiastek 43, zwany dziś technetem..
Właściwości renu
Wygląd fizyczny
Ren jest zwykle sprzedawany w postaci szarawego proszku. Jego metaliczne kawałki, zwykle kuliste krople, są srebrnoszare, które są również bardzo błyszczące..
Masa cząsteczkowa
186,207 g / mol
Liczba atomowa
75
Temperatura topnienia
3186 ºC
Temperatura wrzenia
5630 ºC
Gęstość
-W temperaturze pokojowej: 21,02 g / cm3
-Bezpośrednio w temperaturze topnienia: 18,9 g / cm3
Ren to metal, który ma prawie dwukrotnie większą gęstość niż sam ołów. Zatem kulę renu ważącą 1 gram można przyrównać do solidnego kryształu ołowiu o tej samej masie.
Elektroujemność
1,9 w skali Paulinga
Energie jonizacji
Pierwsza: 760 kJ / mol
Po drugie: 1260 kJ / mol
Po trzecie: 2510 kJ / mol
Molowa pojemność cieplna
25,48 J / (mol K)
Przewodność cieplna
48,0 W / (mK)
Rezystancja
193 nΩ m
Twardość Mohsa
7
Izotopy
Atomy renu występują w przyrodzie jako dwa izotopy: 185Re, z obfitością 37,4%; Y 187Re, z obfitością 62,6%. Ren jest jednym z tych pierwiastków, których najobficiej występujący izotop jest radioaktywny; jednak okres półtrwania 187Re jest bardzo duży (4.121010 lat), więc jest praktycznie uważany za stabilny.
Reaktywność
Metal renu to materiał odporny na rdzę. Kiedy to zrobi, jego rdza, RedwaLUB7, ulatnia się w wysokich temperaturach i pali się żółtawo-zielonym płomieniem. Kawałki renu są odporne na atak HNO3 stężony; ale gdy jest gorący, rozpuszcza się, tworząc kwas renicowy i dwutlenek azotu, który zmienia kolor na brązowy:
Re + 7HNO3 → HReO4 + 7 NIEdwa + 3HdwaLUB
Chemia renu jest ogromna, ponieważ jest on zdolny do tworzenia związków o szerokim spektrum stopni utlenienia, a także tworzenia wiązania kwadrupolowego między dwoma atomami renu (cztery wiązania kowalencyjne Re-Re)..
Struktura i konfiguracja elektroniczna
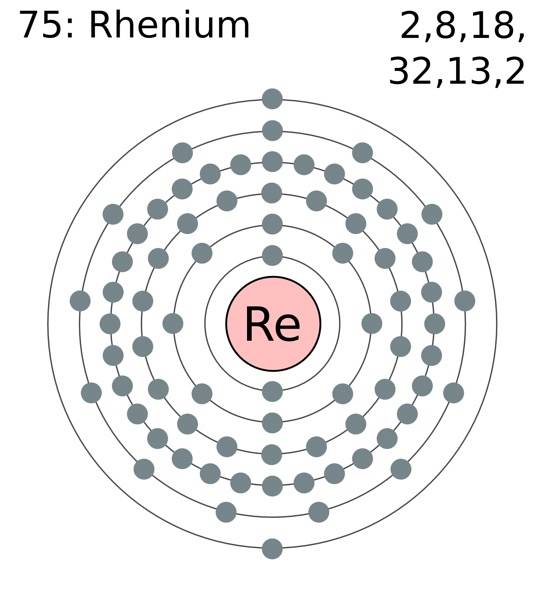
Atomy renu grupują się w swoich kryształach, tworząc zwartą strukturę heksagonalną hcp, która charakteryzuje się dużą gęstością. Jest to zgodne z faktem, że jest to metal o dużej gęstości. Metaliczne wiązanie, produkt nakładania się ich zewnętrznych orbitali, utrzymuje silną spójność atomów Re.
W tym metalicznym wiązaniu Re-Re uczestniczą elektrony walencyjne, które są zgodne z konfiguracją elektronową:
[Xe] 4f14 5 d5 6sdwa
W zasadzie to orbitale 5d i 6s zachodzą na siebie, aby zagęścić atomy Re w strukturze hcp. Zauważ, że jego elektrony sumują się w sumie do 7, co odpowiada liczbie jego grupy w układzie okresowym..
Liczby utleniania
Elektroniczna konfiguracja renu pozwala od razu zobaczyć, że jego atom jest w stanie stracić do 7 elektronów, aby stać się hipotetycznym kationem Re7+. Kiedy zakłada się istnienie Re7+ w jakimkolwiek związku renu, na przykład w RedwaLUB7 (Redwa7+LUB7dwa-), ma stopień utlenienia +7, Re (VII).
Inne dodatnie stopnie utlenienia renu to: +1 (Re+), +2 (Redwa+), +3 (Re3+) i tak dalej, aż do +7. Ponadto ren może pozyskiwać elektrony, stając się anionem. W takich przypadkach mówi się, że ma ujemny stopień utlenienia: -3 (Re3-), -2 (Redwa-) i -1 (Re-).
Aplikacje
Benzyna
Ren wraz z platyną służy do tworzenia katalizatorów, które zwiększają liczbę oktanową benzyny, jednocześnie obniżając zawartość ołowiu. Z drugiej strony katalizatory renowe są wykorzystywane w wielu reakcjach uwodornienia, ze względu na ich odporność na zatrucie azotem, fosforem i siarką..
Superstopy ogniotrwałe
Ren jest metalem ogniotrwałym ze względu na wysoką temperaturę topnienia. Dlatego jest dodawany do stopów niklu, aby były ogniotrwałe i odporne na wysokie ciśnienia i temperatury. Te nadstopy są najczęściej używane do projektowania turbin i silników statków lotniczych..
Włókna wolframowe
Ren może również tworzyć stopy z wolframem, co poprawia jego ciągliwość, a tym samym ułatwia wytwarzanie włókien. Te włókna renu-wolframu są używane jako źródła promieniowania rentgenowskiego oraz do projektowania termopar zdolnych do pomiaru temperatury do 2200 ° C..
Podobnie, te włókna renu były kiedyś używane do błysków archaicznych aparatów fotograficznych, a teraz do lamp wyrafinowanego sprzętu; takie jak spektrofotometr mas.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Sarah Pierce. (2020). Ren: zastosowania, historia, fakty i izotopy. Nauka. Odzyskany z: study.com
- Narodowe Centrum Informacji Biotechnologicznej. (2020). Ren. Baza danych PubChem., CID = 23947. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2020). Ren. Odzyskane z: en.wikipedia.org
- Dr Doug Stewart. (2020). Fakty dotyczące pierwiastka renu. Źródło: chemicool.com
- Eric Scerri. (18 listopada 2008). Ren. Chemia w jej elementach. Źródło: chemistryworld.com



Jeszcze bez komentarzy