
Historia, właściwości, budowa, otrzymywanie, zastosowania rubidu
Plik rubid Jest to pierwiastek metaliczny należący do grupy 1 układu okresowego: metale alkaliczne, reprezentowane przez symbol chemiczny Rb. Jego nazwa brzmi podobnie do rubinu, a to dlatego, że kiedy zostało odkryte, jego widmo emisyjne wykazywało charakterystyczne linie ciemnoczerwonej barwy..
Jest to jeden z najbardziej reaktywnych metali, jakie istnieją. Jest to pierwszy z metali alkalicznych, który pomimo niewielkiej gęstości tonie w wodzie. Reaguje z nim również bardziej wybuchowo w porównaniu z litem, sodem i potasem. Były eksperymenty, w których pęcherze pękają w miejscu przechowywania (dolne zdjęcie), by spaść i eksplodować w wannach.

Rubid wyróżnia się tym, że jest droższym metalem niż samo złoto; nie tak bardzo z powodu jego niedoboru, ale z powodu jego szerokiego rozkładu mineralogicznego w skorupie ziemskiej i trudności, które pojawiają się podczas izolowania go od związków potasu i cezu..
Wykazuje wyraźną tendencję do łączenia się z potasem w swoich minerałach, będąc zanieczyszczeniami. Nie tylko w kwestiach geochemicznych tworzy duet z potasem, ale także w dziedzinie biochemii.
Organizm „myli” jony K.+ przez te z Rb+; jednakże rubid nie jest dotychczas niezbędnym pierwiastkiem, ponieważ jego rola w metabolizmie nie jest znana. Mimo to suplementy rubidu były stosowane w celu złagodzenia niektórych schorzeń, takich jak depresja i epilepsja. Z drugiej strony oba jony wydzielają fioletowy płomień na ciepło zapalniczki.
Ze względu na wysoki koszt jego zastosowania nie opierają się zbytnio na syntezie katalizatorów czy materiałów, ale jako komponent do różnych urządzeń z teoretycznymi podstawami fizycznymi. Jednym z nich jest zegar atomowy, ogniwa słoneczne i magnetometry. Dlatego czasami rubid jest uważany za niedoceniany lub niedostatecznie zbadany metal..
Indeks artykułów
- 1 Historia
- 2 Właściwości fizyczne i chemiczne
- 2.1 Wygląd
- 2.2 Liczba atomowa (Z)
- 2.3 Masa molowa
- 2.4 Temperatura topnienia
- 2.5 Temperatura wrzenia
- 2.6 Gęstość
- 2.7 Ciepło topnienia
- 2.8 Ciepło parowania
- 2.9 Elektroujemność
- 2.10 Koligacja elektroniczna
- 2.11 Energie jonizacji
- 2.12 Promień atomowy
- 2.13 Przewodność cieplna
- 2.14 Oporność elektryczna
- 2,15 Twardość Mohsa
- 2.16 Reaktywność
- 3 Struktura i konfiguracja elektroniczna
- 3.1 stopnie utlenienia
- 3.2 Klastry
- 4 Gdzie znaleźć i otrzymać
- 4.1 Skorupa ziemska
- 4.2 Związek geochemiczny
- 4.3 Krystalizacja frakcyjna
- 4.4 Elektroliza lub redukcja
- 5 izotopów
- 6 Ryzyka
- 6.1 Metal
- 6.2 Jony
- 7 zastosowań
- 7.1 Kolektor gazu
- 7.2 Pirotechnika
- 7.3 Dodatek
- 7.4 Kondensat Bosego-Einsteina
- 7.5 Diagnostyka guzów
- 7.6 Składnik
- 7.7 Zegary atomowe
- 8 Odniesienia
Fabuła
Rubid został odkryty w 1861 roku przez niemieckich chemików Roberta Bunsena i Gustava Kirchhoffa za pomocą spektroskopii. W tym celu wykorzystali wynaleziony dwa lata wcześniej palnik Bunsena i spektroskop, a także analityczne techniki strącania. Przedmiotem jego badań był minerał lepidolit, którego próbkę pobrano z Saksonii w Niemczech.
Zaczęli od 150 kg minerału lepidolitu, który potraktowali kwasem chloroplatynowym HdwaPtCl6, strącanie heksachloroplatynianu potasu, KdwaPtCl6. Jednak kiedy badali jego widmo przez spalanie go w palniku Bunsena, zdali sobie sprawę, że wykazuje on linie emisyjne, które nie pokrywały się w tym czasie z żadnym innym pierwiastkiem..
Widmo emisyjne tego nowego pierwiastka charakteryzuje się dwoma dobrze określonymi liniami w czerwonym obszarze. Dlatego ochrzczono go imieniem „rubidus”, co oznacza „ciemnoczerwony”. Później Bunsen i Kirchhoff zdołali oddzielić RbdwaPtCl6 od K.dwaPtCl6 przez frakcjonowaną krystalizację; aby ostatecznie zredukować go do soli chlorkowej za pomocą wodoru.
Identyfikując i wyodrębniając sól nowego pierwiastka rubidu, niemieccy chemicy musieli jedynie zredukować ją do stanu metalicznego. Aby to osiągnąć, próbowali na dwa sposoby: stosując elektrolizę do chlorku rubidu lub podgrzewając sól, która jest łatwiejsza do zredukowania, na przykład jego winian. W ten sposób narodził się metaliczny rubid.
Fizyczne i chemiczne właściwości
Wygląd
Miękki, srebrnoszary metal. Jest tak gładki, że wygląda jak masło. Zwykle jest pakowany w szklane ampułki, w których dominuje obojętna atmosfera, która chroni go przed reakcją z powietrzem..
Liczba atomowa (Z)
37
Masa cząsteczkowa
85,4678 g / mol
Temperatura topnienia
39 ºC
Temperatura wrzenia
688 ºC
Gęstość
W temperaturze pokojowej: 1,532 g / cm3
W temperaturze topnienia: 1,46 g / cm3
Gęstość rubidu jest większa niż wody, więc będzie on tonął, reagując z nim gwałtownie.
Ciepło topnienia
2,19 kJ / mol
Ciepło parowania
69 kJ / mol
Elektroujemność
0,82 w skali Paulinga
Elektroniczne powinowactwo
46,9 kJ / mol
Energie jonizacji
-Po pierwsze: 403 kJ / mol (Rb+ gazowy)
-Po drugie: 2632,1 kJ / mol (Rbdwa+ gazowy)
-Po trzecie: 3859,4 kJ / mol (Rb3+ gazowy)
Radio atomowe
248 pm (empiryczna)
Przewodność cieplna
58,2 W / (mK)
Rezystancja
128 nm przy 20 ° C
Twardość Mohsa
0.3. Dlatego nawet talk jest twardszy niż metaliczny rubid..
Reaktywność

Rubid jest jednym z najbardziej reaktywnych metali alkalicznych, po cezie i franku. Gdy tylko zostanie wystawiony na działanie powietrza, zaczyna się palić, a jeśli zostanie uderzony, wystrzeliwuje lekkie iskry. Po podgrzaniu emituje również fioletowy płomień (górne zdjęcie), co jest pozytywnym wynikiem testu na jony Rb.+.
Reaguje z tlenem, tworząc mieszaninę nadtlenków (RbdwaLUBdwa) i ponadtlenki (RbOdwa). Chociaż nie reaguje z kwasami i zasadami, reaguje gwałtownie z wodą, wytwarzając wodorotlenek rubidu i gazowy wodór:
Rb (s) + HdwaO (l) => RbOH (aq) + Hdwa(sol)
Reaguje z wodorem, tworząc odpowiedni wodorek:
Rb (s) + Hdwa(g) => 2RbH (s)
A także z halogenami i siarką wybuchowo:
2Rb (s) + Cldwa(g) => RbCl (s)
2Rb (s) + S (l) => RbdwaH.H)
Chociaż rubid nie jest uważany za pierwiastek toksyczny, jest potencjalnie niebezpieczny i stwarza zagrożenie pożarem w kontakcie z wodą i tlenem..
Struktura i konfiguracja elektroniczna
Atomy rubidu są ułożone w taki sposób, że tworzą kryształ o sześciennej strukturze wyśrodkowanej na ciele (bcc, akronim w języku angielskim z centrowaniem sześciennym). Taka struktura jest charakterystyczna dla metali alkalicznych, które są lekkie i mają tendencję do unoszenia się na wodzie; z wyjątkiem puchu rubidowego (cezu i franka).
W kryształach rubidu bcc ich atomy Rb oddziałują ze sobą dzięki wiązaniu metalicznemu. Jest to rządzone przez „morze elektronów” z jego powłoki walencyjnej, z orbity 5s zgodnie z jego konfiguracją elektroniczną:
[Kr] 5s1
Wszystkie orbitale 5s z ich pojedynczym elektronem zachodzą na siebie we wszystkich wymiarach metalicznych kryształów rubidu. Jednak te oddziaływania są słabe, ponieważ gdy schodzimy przez grupę metali alkalicznych, orbitale stają się bardziej rozproszone, a zatem wiązanie metaliczne słabnie..
Dlatego temperatura topnienia rubidu wynosi 39ºC. Podobnie, jego słabe wiązanie metaliczne wyjaśnia miękkość jego ciała stałego; tak miękki, że wygląda jak srebrne masło.
Nie ma wystarczających informacji bibliograficznych dotyczących zachowania kryształów pod wysokim ciśnieniem; jeśli istnieją gęstsze fazy o wyjątkowych właściwościach, takich jak sód.
Liczby utleniania
Jego konfiguracja elektroniczna wskazuje od razu, że rubid silnie traci swój pojedynczy elektron, aby stać się izoelektronicznym w stosunku do kryptonu będącego gazem szlachetnym. Kiedy tak się dzieje, powstaje jednowartościowy kation Rb+. Mówi się wtedy, że w swoich związkach ma stopień utlenienia +1, gdy zakłada się istnienie tego kationu.
Ze względu na tendencję rubidu do utleniania założenie, że istnieją jony Rb+ w swoich związkach jest poprawna, co z kolei wskazuje na jonowy charakter tych związków.
W prawie wszystkich związkach rubidu wykazuje stopień utlenienia +1. Oto ich przykłady:
-Chlorek rubidu, RbCl (Rb+Cl-)
-Wodorotlenek rubidu, RbOH (Rb+ O-)
-Węglan rubidu, RbdwaWSPÓŁ3 (Rbdwa+WSPÓŁ3dwa-)
-Tlenek rubidu, RbdwaO (Rbdwa+LUBdwa-)
-Nadtlenek rubidu, RbOdwa (Rb+LUBdwa-)
Chociaż rubid jest bardzo rzadki, może mieć również ujemny stopień utlenienia: -1 (Rb-). W tym przypadku mówilibyśmy o „rubididzie”, gdyby utworzył związek z pierwiastkiem mniej elektroujemnym niż on, lub gdyby został poddany specjalnym i rygorystycznym warunkom.
Klastry
Istnieją związki, w których każdy atom Rb indywidualnie przedstawia stopnie utlenienia z wartościami ułamkowymi. Na przykład w Rb6O (Rb6dwa+LUBdwa-) i Rb9LUBdwa (Rb94+LUBdwadwa-) ładunek dodatni jest rozłożony na zbiór atomów Rb (klastry). Tak więc w Rb6Lub teoretycznie stopień utlenienia wynosiłby +1/3; podczas gdy w Rb9LUBdwa, + 0,444 (4/9).
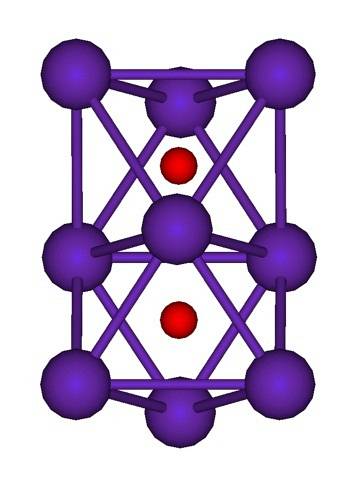
Struktura klastra Rb jest pokazana powyżej.9LUBdwa reprezentowany przez model sfer i prętów. Zwróć uwagę, jak dziewięć atomów Rb „otacza” aniony O.dwa-.
W drodze elukubracji jest tak, jakby część oryginalnych metalicznych kryształów rubidu pozostawała niezmieniona podczas oddzielania ich od kryształu macierzystego. W trakcie tego procesu tracą elektrony; te niezbędne do przyciągnięcia Odwa-, a wynikowy ładunek dodatni jest rozłożony na wszystkie atomy tego klastra (zbiór lub agregaty atomów Rb).
Tak więc w tych gromadach rubidu nie można formalnie założyć istnienia Rb.+. Rb6O i Rb9LUBdwa Są one klasyfikowane jako podtlenki rubidu, w których ta pozorna anomalia posiadania nadmiaru atomów metalu w stosunku do anionów tlenkowych jest spełniona.
Gdzie znaleźć i uzyskać
Skorupa ziemska

Rubid jest 23. najbardziej rozpowszechnionym pierwiastkiem w skorupie ziemskiej, a jego ilość jest porównywalna z metalami cynk, ołów, cez i miedź. Szczegół jest taki, że jego jony są szeroko rozproszone, więc nie dominuje w żadnym minerale jako główny pierwiastek metaliczny, a jego rudy są również rzadkie..
Z tego powodu rubid jest bardzo drogim metalem, nawet bardziej niż samo złoto, ponieważ proces jego uzyskiwania z rud jest złożony ze względu na trudność jego eksploatacji..
W naturze, biorąc pod uwagę jego reaktywność, rubid nie występuje w swoim rodzimym stanie, ale jako tlenek (RbdwaO), chlorek (RbCl) lub w towarzystwie innych anionów. Jego „wolne” jony Rb+ występują w morzach o stężeniu 125 µg / L, a także w gorących źródłach i rzekach.
Wśród minerałów skorupy ziemskiej, które zawierają ją w stężeniu poniżej 1%, mamy:
-Leucyt, K [AlSidwaLUB6]
-Polucita, Cs (Sidwacześć6NHdwaLUB
-Carnalite, KMgCl36HdwaLUB
-Zinnwaldite, KLiFeAl (AlSi3)LUB10(OH, F)dwa
-Amazonit, Pb, KAlSi3LUB8
-Petalite, LiAlSi4LUB10
-Biotyt, K (Mg, Fe)3AlSi3LUB10(OH, F)dwa
-Rubicline, (Rb, K) AlSi3LUB8
-Lepidolit, K (Li, Al)3(Tak, Al)4LUB10(F, OH)dwa
Stowarzyszenie Geochemiczne
Wszystkie te minerały mają jedną lub dwie cechy wspólne: są to krzemiany potasu, cezu lub litu lub sole mineralne tych metali..
Oznacza to, że rubid ma silną tendencję do łączenia się z potasem i cezem; Może nawet zastąpić potas podczas krystalizacji minerałów lub skał, jak to ma miejsce w osadach pegmatytów, gdy krystalizuje magma. Zatem rubid jest produktem ubocznym eksploatacji i rafinacji tych skał i ich minerałów..
Rubid można również znaleźć w zwykłych skałach, takich jak granit, gliny i bazalt, a nawet w osadach karbońskich. Ze wszystkich naturalnych źródeł lepidolit stanowi główną rudę, z której jest eksploatowany do celów handlowych..
Z kolei w karnalicie rubid można znaleźć jako zanieczyszczenia RbCl o zawartości 0,035%. W wyższym stężeniu występują osady polucytu i rubikiny, które mogą zawierać do 17% rubidu..
Jego geochemiczne powiązanie z potasem wynika z podobieństwa ich promieni jonowych; Rb+ jest większy niż K.+, ale różnica w rozmiarach nie jest przeszkodą dla pierwszego w zastąpieniu drugiego w kryształach mineralnych.
Krystalizacja frakcyjna
Niezależnie od tego, czy zaczynamy od lepidolitu, polucytu, czy też któregokolwiek z wyżej wymienionych minerałów, wyzwanie pozostaje takie samo w mniejszym lub większym stopniu: oddzielenie rubidu od potasu i cezu; to znaczy zastosować techniki rozdzielania mieszanin, które pozwalają na stosowanie związków lub soli rubidu z jednej strony, a potasu i cezu z drugiej..
Jest to trudne, ponieważ te jony (K.+, Rb+ i Cs+) mają duże podobieństwo chemiczne; Reagują w ten sam sposób, tworząc te same sole, które prawie nie różnią się od siebie dzięki swojej gęstości i rozpuszczalności. Dlatego stosuje się krystalizację frakcyjną, aby mogły one krystalizować powoli iw kontrolowany sposób..
Na przykład ta technika jest używana do oddzielania mieszaniny węglanów i ałunu od tych metali. Procesy rekrystalizacji należy powtarzać kilkakrotnie, aby zapewnić kryształy o większej czystości i wolne od współstrąconych jonów; sól rubidu, która krystalizuje z jonami K.+ lub Cs+ na jej powierzchni lub wewnątrz.
Bardziej nowoczesne techniki, takie jak zastosowanie żywicy jonowymiennej lub eterów koronowych jako środków kompleksujących, również pozwalają na izolację jonów Rb.+.
Elektroliza lub redukcja
Po oddzieleniu i oczyszczeniu soli rubidu następnym i ostatnim krokiem jest redukcja kationów Rb+ do litego metalu. W tym celu sól jest topiona i poddawana elektrolizie, tak że rubid wytrąca się na katodzie; lub stosuje się silny środek redukujący, taki jak wapń i sód, zdolny do szybkiej utraty elektronów, a tym samym do redukcji rubidu.
Izotopy
Rubid występuje na Ziemi jako dwa naturalne izotopy: 85Rb i 87Rb. Pierwsza ma obfitość 72,17%, a druga 27,83%.
Plik 87Rb jest odpowiedzialny za radioaktywność tego metalu; jednak jego promieniowanie jest nieszkodliwe, a nawet korzystne dla analizy datowania. Jego okres półtrwania (t1/2) wynosi 4,91010 lat, których rozpiętość przekracza wiek Wszechświata. Kiedy się rozpada, staje się stabilnym izotopem 87Pan.
Dzięki temu izotop ten służył do datowania wieku ziemskich minerałów i skał występujących od początku istnienia Ziemi..
Oprócz izotopów 85Rb i 87Rb, istnieją inne syntetyczne i radioaktywne o zmiennym i znacznie krótszym czasie życia; Na przykład on 82Rb (t1/2= 76 sekund), 83Rb (t1/2= 86,2 dni), 84Rb (t1/2= 32,9 dnia) i 86Rb (t1/2= 18,7 dnia). Ze wszystkich z nich 82Rb jest najczęściej używany w badaniach medycznych.
Ryzyka
Metal
Rubid jest metalem tak reaktywnym, że musi być przechowywany w szklanych ampułkach w obojętnej atmosferze, aby nie reagował z tlenem w powietrzu. Jeśli blister pęknie, metal można umieścić w nafcie lub oleju mineralnym, aby go chronić; Jednak w końcu zostanie utleniony przez rozpuszczony w nich tlen, powodując powstanie nadtlenków rubidu.
Jeśli wręcz przeciwnie, zdecyduje się położyć go na przykład na drewnie, w końcu spali się fioletowym płomieniem. Jeśli jest dużo wilgoci, spali się, gdy zostanie wystawiony na działanie powietrza. Kiedy duży kawałek rubidu zostanie wrzucony do wody, eksploduje energicznie, nawet zapalając wytwarzany wodór.
Dlatego rubid jest metalem, z którym nie każdy powinien się obchodzić, ponieważ praktycznie wszystkie jego reakcje są wybuchowe..
Jon
W przeciwieństwie do metalicznego rubidu, jego jony Rb+ nie stanowią żadnego widocznego zagrożenia dla istot żywych. Te rozpuszczone w wodzie oddziałują z komórkami w taki sam sposób, jak jony K.+.
Dlatego rubid i potas mają podobne zachowania biochemiczne; jednak rubid nie jest pierwiastkiem podstawowym, podczas gdy potas jest. W ten sposób znaczące ilości Rb+ może gromadzić się w komórkach, krwinkach czerwonych i wnętrznościach bez negatywnego wpływu na organizm żadnego zwierzęcia.
W rzeczywistości oszacowano, że dorosły samiec o masie 80 kg zawiera około 37 mg rubidu; a ponadto wzrost tego stężenia rzędu 50 do 100 razy nie prowadzi do niepożądanych objawów.
Jednak nadmiar jonów Rb+ może skończyć się wyparciem jonów K.+; w konsekwencji osoba będzie cierpieć z powodu silnych skurczów mięśni aż do śmierci.
Oczywiście rozpuszczalne sole lub związki rubidu mogą wywołać to natychmiast, więc żadna z nich nie powinna być spożywana. Ponadto przy prostym kontakcie może powodować oparzenia, a wśród najbardziej toksycznych można wymienić fluorek (RbF), wodorotlenek (RbOH) i cyjanek (RbCN) rubidu.
Aplikacje
Kolektor gazu
Rubid jest używany do wychwytywania lub usuwania śladów gazów, które mogą znajdować się w próżniowo uszczelnionych rurkach. Właśnie ze względu na ich dużą skłonność do wychwytywania w nich tlenu i wilgoci, eliminują je na swojej powierzchni w postaci nadtlenków.
Pirotechnika
Podczas spalania soli rubidu wydzielają charakterystyczny czerwono-fioletowy płomień. Niektóre fajerwerki mają te sole w swoim składzie, więc eksplodują tymi kolorami.
Suplement
Chlorek rubidu został przepisany w celu zwalczania depresji, ponieważ badania wykazały niedobór tego pierwiastka u osób cierpiących na tę chorobę. Był również stosowany jako środek uspokajający i do leczenia epilepsji.
Kondensat Bosego-Einsteina
Atomy izotopowe 87Rb zostały użyte do stworzenia pierwszego kondensatu Bosego-Einsteina. Ten stan skupienia polega na tym, że atomy w temperaturze dość bliskiej zeru absolutnemu (0 K) są zgrupowane lub „skondensowane”, zachowując się tak, jakby były jednością..
Tym samym rubid był bohaterem tego triumfu w dziedzinie fizyki, a dzięki tej pracy w 2001 roku Eric Cornell, Carl Wieman i Wolfgang Ketterle otrzymali Nagrodę Nobla..
Diagnoza guza
Syntetyczny izotop promieniotwórczy 82Rb rozpada się poprzez emisję pozytonów, które są wykorzystywane do gromadzenia się w tkankach bogatych w potas; takie jak te zlokalizowane w mózgu lub sercu. Jest zatem używany do analizy czynności serca i obecności ewentualnych guzów w mózgu za pomocą pozytonowej tomografii emisyjnej..
Składnik
Jony rubidu znalazły swoje miejsce w różnego rodzaju materiałach lub mieszaninach. Na przykład jego stopy zostały wykonane ze złota, cezu, rtęci, sodu i potasu. Został dodany do szkła i ceramiki prawdopodobnie w celu podwyższenia ich temperatury topnienia.
W ogniwach słonecznych perowskity zostały dodane jako ważny składnik. Zbadano również możliwość jego zastosowania jako generatora termoelektrycznego, materiału przenoszącego ciepło w kosmosie, paliwa w jonowych silnikach napędowych, medium elektrolitycznego do baterii alkalicznych i magnetometrów atomowych..
Zegary atomowe
Z rubidu i cezu wyprodukowano słynne wysoce precyzyjne zegary atomowe, wykorzystywane m.in. w satelitach GPS, dzięki którym właściciele swoich smartfonów mogą poznać swoje położenie podczas poruszania się po drodze.
Bibliografia
- Bond Tom. (29 października 2008). Rubid. Źródło: chemistryworld.com
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Wikipedia. (2019). Rubid. Odzyskane z: en.wikipedia.org
- Narodowe Centrum Informacji Biotechnologicznej. (2019). Rubid. Baza danych PubChem. CID = 5357696. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Chellan, P. i Sadler, P. J. (2015). Żywioły i lekarstwa. Transakcje filozoficzne. Seria A, nauki matematyczne, fizyczne i inżynieryjne, 373 (2037), 20140182. doi: 10.1098 / rsta.2014.0182
- Mayo Foundation for Medical Education and Research. (2019). Rubidium Rb 82 (droga dożylna). Odzyskany z: mayoclinic.org
- Marques Miguel. (s.f.). Rubid. Odzyskany z: nautilus.fis.uc.pt
- James L. Dye. (12 kwietnia 2019). Rubid. Encyclopædia Britannica. Odzyskany z: britannica.com
- Dr Doug Stewart. (2019). Fakty dotyczące pierwiastka rubidu. Chemicool. Źródło: chemicool.com
- Michael Pilgaard. (10 maja 2017). Reakcje chemiczne rubidu. Odzyskane z: pilgaardelements.com



Jeszcze bez komentarzy