
Budowa chemiczna kwasu borowego, właściwości, preparat, zastosowania
Plik kwas borowy jest związkiem nieorganicznym, którego wzór chemiczny to H.3BO3. Składa się z białej lub bezbarwnej substancji stałej. Jest to słaby kwas, który w roztworze wodnym wytwarza, w zależności od stężenia, pH między 3,8 a 4,8. Jest słabo rozpuszczalny w zimnej wodzie i umiarkowanie rozpuszczalny w gorącej wodzie..
Kwas borowy został odkryty w 1702 roku przez Wilhelma Homberga (1652-1713), który potraktował boraks kwasem siarkowym, uzyskując roztwór o działaniu leczniczym, który otrzymał nazwę uspokajającej wody Homberga..

Zaznacza się jednak również, że Homberg przygotował kwas borowy przez dodanie wody do boraksu i ogrzewanie roztworu do odparowania, pozostawiając w ten sposób kryształy kwasu borowego w osadzie..
Kwas ten jest bardzo użytecznym związkiem, który ma liczne zastosowania w przemyśle i medycynie, jest również używany jako środek owadobójczy, środek do konserwacji drewna, opóźniacz palenia i jest składnikiem roztworu buforowego pH..
Indeks artykułów
- 1 Struktura chemiczna
- 1.1 Kryształy
- 2 Właściwości
- 2.1 Nazwy
- 2.2 Masa molowa
- 2.3 Wygląd fizyczny
- 2.4 Zapach
- 2.5 Smak
- 2.6 Temperatura topnienia
- 2.7 Temperatura wrzenia
- 2.8 Rozpuszczalność w wodzie
- 2.9 Rozpuszczalność w innych rozpuszczalnikach
- 2.10 Współczynnik podziału oktanol / woda
- 2.11 Kwasowość (pKa)
- 2,12 pH
- 2.13 Prężność par
- 2.14 Stabilność
- 2.15 Rozkład
- 2.16 Reaktywność
- 3 Przygotowanie
- 4 Zastosowania
- 4.1 W przemyśle
- 4.2 W medycynie
- 4.3 Środek owadobójczy
- 4.4 Konserwacja
- Bufor pH 4,5
- 4.6 Reaktory jądrowe
- 4.7 Rolnictwo
- 5 Przeciwwskazania
- 6 Odnośniki
Struktura chemiczna
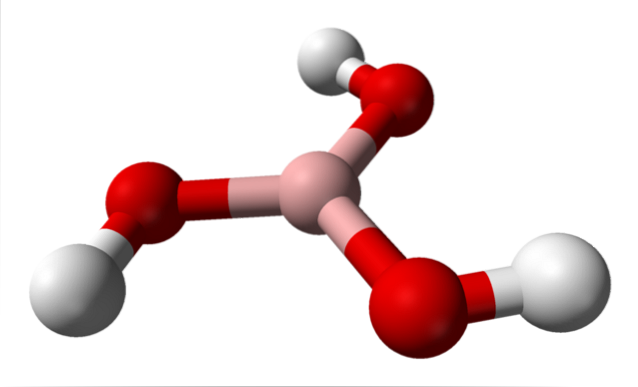
Na górnym obrazku mamy samą cząsteczkę H3BO3. Zauważ, że atomy wodoru, reprezentowane przez białe kule, nie są związane z centralnym atomem boru, jak może sugerować wzór chemiczny; ale raczej atomom tlenu, reprezentowanym przez czerwone kule.
Tak więc wygodniejszym, choć rzadziej stosowanym wzorem dla kwasu borowego jest B (OH)3, co wskazuje, że jego kwasowość jest spowodowana jonami H.+ uwolnione z ich grup OH. Cząsteczka B (OH)3 ma geometrię płaszczyzny trygonalnej, z atomem boru o chemicznej hybrydyzacji spdwa.
B (OH)3 Jest to cząsteczka silnie kowalencyjna, ponieważ różnica elektroujemności między atomem boru a tlenem nie jest zbyt duża; więc wiązania B-O są zasadniczo kowalencyjne. Zwróć również uwagę, że struktura tej cząsteczki przypomina strukturę przędzarki. Czy może obracać się wokół własnej osi w ten sam sposób?
Kryształy
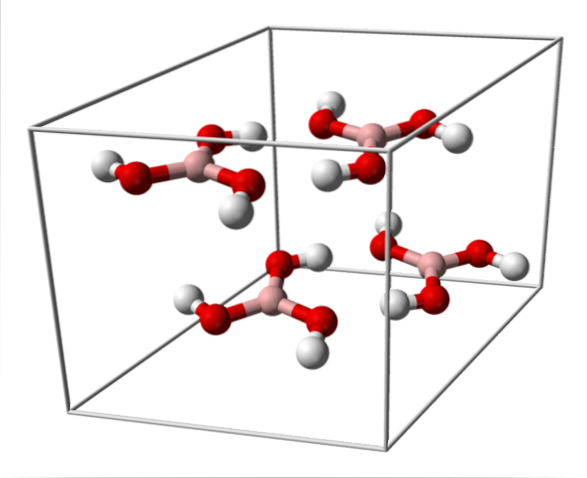
Górny obraz przedstawia komórkę elementarną odpowiadającą trójskośnej strukturze krystalicznej kwasu borowego, która w pewnych warunkach syntezy może przyjąć zwartą strukturę heksagonalną. Zauważ, że na komórkę elementarną przypadają cztery cząsteczki i że są one ułożone naprzemiennie w dwóch warstwach, A i B (nie są one nałożone jedna na drugą).
Ze względu na symetrię i orientację wiązań B-OH można przyjąć, że B (OH)3 jest niepolarny; Jednak istnienie międzycząsteczkowych wiązań wodorowych zmienia tę historię. Każda cząsteczka B (OH)3 dając lub otrzymując trzy z tych mostków, w sumie sześć oddziaływań dipol-dipol, jak widać na poniższym obrazku:
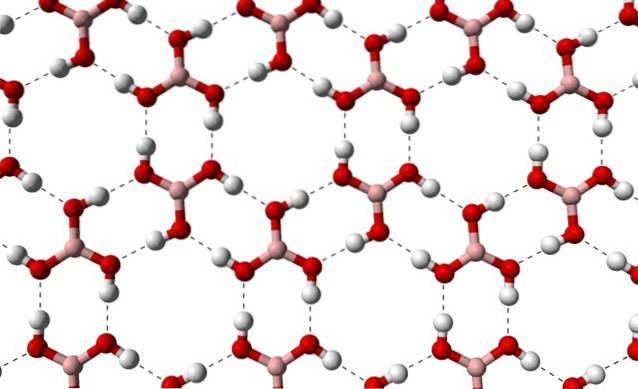
Zauważ, że te wiązania wodorowe są kierunkowymi interakcjami, które rządzą kryształami kwasu borowego i ustanawiają wzory aspektów ozdobnych; pierścienie wewnętrzne być może mają wystarczająco dużo miejsca, aby zatkać niektóre zanieczyszczenia, których nie ma w defektach kryształu.
Te wiązania wodorowe, pomimo niskiej masy cząsteczkowej B (OH)3, utrzymują ich szkło na tyle spójne, że do stopienia potrzebna jest temperatura 171ºC. Nie wiadomo, jaki wpływ wysokie ciśnienia (rzędu GPa) miałyby na warstwy molekularne B (OH)3.
Nieruchomości
Nazwy
IUPAC: kwas borowy i triowodorotlenek boru. Inne nazwy: kwas ortoborowy, kwas borowy, sasolit, borofaks i trihydroksyboran.
Masa cząsteczkowa
61,83 g / mol
Wygląd fizyczny
Przejrzyste, bezbarwne, krystalicznie białe ciało stałe. Jest również dostępny w postaci granulatu lub białego proszku. W dotyku lekko kremowy.
Zapach
Toaleta
Smak
Lekko gorzki
Temperatura topnienia
170,9 ° C
Temperatura wrzenia
300 ºC
Rozpuszczalność w wodzie
Umiarkowanie rozpuszczalny w zimnej wodzie i rozpuszczalny w gorącej wodzie:
2,52 g / 100 ml (0 ºC)
27,50 g / 100 ml (100 ºC)
Kwas borowy jest częściowo rozpuszczalny w wodzie i ma tendencję do w niej tonięcia. Ta rozpuszczalność ma tendencję do zwiększania się w obecności kwasów, takich jak kwas solny, cytrynowy i winowy..
Rozpuszczalność w innych rozpuszczalnikach
-Glicerol: 17,5% w 25 ° C
-Glikol etylenowy: 18,5% w 25 ° C
-Aceton: 0,6% przy 25 ºC
-Octan etylu: 1,5% w 25 ° C
-Metanol: 172 g / L w 25 ° C
-Etanol: 94,4 g / L w 25 ° C
Współczynnik podziału oktanol / woda
Log P = -0,29
Kwasowość (pKa)
9.24. 12.4. 13.3. Są to trzy stałe ich odpowiednich dysocjacji, aby uwolnić H.+ w wodzie.
pH
3,8 - 4,8 (3,3% w roztworze wodnym)
5,1 (0,1 molowe)
Ciśnienie pary
1,6 10-6 mmHg
Stabilność
Stabilny w wodzie
Rozkład
Rozkłada się po podgrzaniu powyżej 100 ° C, tworząc bezwodnik borowy i wodę.
Reaktywność
Kwas borowy tworzy rozpuszczalne sole z jednowartościowymi kationami, na przykład: Nadwab4LUB7.10HdwaO i nierozpuszczalne sole z dwuwartościowymi kationami, CaB4LUB7.6HdwaLUB.
W roztworze wodnym tworzy kwaśny roztwór, myśląc, że ta właściwość wynika z odejmowania grup OH- z wody. Kwas borowy jest klasyfikowany jako słaby kwas typu Lewisa.
Kwas borowy reaguje z glicerolem i mannitolem, zwiększając kwasowość środowiska wodnego. Wartość pKa zmienia się z 9,2 na 5, ze względu na tworzenie się chelatu boru-mannitolu [BC6H.8LUBdwa(O)dwa]-, która uwalnia H.+.
Przygotowanie
Kwas borowy występuje w stanie wolnym w emanacjach wulkanicznych w regionach takich jak Toskania we Włoszech, Wyspy Lipari oraz w stanie Nevada w USA. Występuje również w minerałach, takich jak boraks, boracyt, uleksyt i kolemanit..
Kwas borowy otrzymywany jest głównie w reakcji mineralnego boraksu (dekahydratu czteroboranu sodu) z kwasami mineralnymi, takimi jak kwas solny, siarkowy itp..
Nadwab4LUB910HdwaO + HCl => 4H3BO3 + 2 NaCl + 5 H.dwaLUB
Jest również przygotowywany przez hydrolizę trihalogenku boru i diboranu..
Kwas borowy otrzymuje się z kolemanitu (Cadwab6LUBjedenaście6 HdwaLUB). Procedura polega na potraktowaniu minerału kwasem siarkowym w celu rozpuszczenia związków boru.
Następnie roztwór zawierający kwas borowy oddziela się od nierozpuszczonych fragmentów. Roztwór poddaje się działaniu siarkowodoru, aby wytrącić zanieczyszczenia arszenikiem i żelazem. Supernatant jest schładzany w celu wytworzenia osadu kwasu borowego i oddzielenia go od zawiesiny..
Aplikacje
W przemyśle
Do produkcji włókna szklanego stosuje się kwas borowy. Pomagając obniżyć temperaturę topnienia, zwiększa wytrzymałość i wydajność włókien szklanych tekstylnych: materiału używanego do wzmacniania plastiku używanego na statkach, rurach przemysłowych i obwodach komputerowych..
Kwas borowy uczestniczy w produkcji szkła borokrzemianowego, co pozwala na uzyskanie szkła odpornego na zmiany temperatury, nadającego się do użytku w kuchniach domowych, w szklanych laboratoriach, świetlówkach, światłowodach, ekranach LCD itp..
Jest stosowany w przemyśle metalurgicznym do utwardzania i obróbki stopów stali, a także do promowania metalicznego powlekania materiałów.
Jest stosowany jako składnik chemiczny w szczelinowaniu hydraulicznym (fracking): metodzie stosowanej w wydobyciu ropy i gazu. Kwas borowy działa jako środek zmniejszający palność w celulozie, tworzywach sztucznych i materiałach tekstylnych, które są impregnowane kwasem borowym w celu zwiększenia ich odporności na ogień..
W medycynie
Kwas borowy jest rozcieńczony w płynie do przemywania oczu. Kapsułki żelatynowe z kwasem borowym są stosowane w leczeniu zakażeń grzybiczych, zwłaszcza Candida albicans. Stosowany był również w leczeniu trądziku.
Kwas borowy jest spryskiwany na skarpetkach, aby zapobiec infekcjom stóp, takich jak stopa sportowca. Podobnie roztwory zawierające kwas borowy są stosowane w leczeniu zapalenia ucha zewnętrznego u ludzi i zwierząt..
Do butelek używanych do zbierania moczu dodawany jest kwas borowy, który zapobiega skażeniu bakteryjnemu przed badaniem w laboratoriach diagnostycznych..
Środek owadobójczy
Kwas borowy służy do kontrolowania rozmnażania się owadów, takich jak karaluchy, termity, mrówki itp. Nie zabija natychmiast karaluchów, ponieważ najpierw wpływa na ich układ pokarmowy i nerwowy, a także niszczy ich egzoszkielet.
Kwas borowy działa powoli, umożliwiając owadom, które go połknęły, kontakt z innymi owadami, rozprzestrzeniając w ten sposób zatrucie..
Ochrona
Kwas borowy służy do zapobiegania atakowi drewna przez grzyby i owady, używany w tym celu w połączeniu z glikolem etylenowym. Zabieg ten jest również skuteczny w zwalczaniu mułu i glonów..
Bufor PH
Kwas borowy i jego sprzężona zasada tworzą układ buforowy o pKa = 9,24, co wskazuje, że bufor ten jest najbardziej skuteczny przy zasadowym pH, co nie jest typowe dla istot żywych. Jednak do regulacji pH w basenach stosowany jest bufor boranowy..
Reaktor nuklearny
Kwas borowy ma zdolność wychwytywania neutronów termicznych, co zmniejsza możliwość niekontrolowanego rozszczepienia jądra atomowego, które może prowadzić do wypadków jądrowych..
rolnictwo
Bor jest pierwiastkiem niezbędnym do wzrostu roślin, co doprowadziło do wykorzystania kwasu borowego jako wkładu pierwiastka. Jednak zbyt dużo kwasu borowego może szkodzić roślinom, zwłaszcza owocom cytrusowym..
Przeciwwskazania
Należy unikać stosowania kwasu borowego na odsłoniętą skórę, rany lub oparzenia produktu, który umożliwia jego wchłanianie. Jest to toksyczny związek w organizmie, który w niektórych przypadkach może powodować omdlenia, drgawki, skurcze, tiki na twarzy i niskie ciśnienie krwi..
W przypadku stosowania kapsułek dopochwowych z kwasem borowym u kobiet w ciąży należy skonsultować się z lekarzem, ponieważ wskazano, że może to powodować deformacje płodu i zmniejszenie masy ciała dziecka po urodzeniu..
Należy również unikać umieszczania kwasu borowego, stosowanego jako środek owadobójczy, w miejscach niedostępnych dla dzieci, ponieważ dzieci są bardziej podatne na toksyczne działanie kwasu borowego, ustalając w nich śmiertelną dawkę na 2000 do 3000 mg.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Wikipedia. (2019). Kwas borowy. Odzyskane z: en.wikipedia.org
- Narodowe Centrum Informacji Biotechnologicznej. (2019). Kwas borowy. Baza danych PubChem. CID = 7628. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Redaktorzy Encyclopaedia Britannica. (28 marca 2019). Kwas borowy. Encyclopædia Britannica. Odzyskany z: britannica.com
- Carrier Vibrating. (9 listopada 2018). Ukryte zastosowania kwasu borowego w życiu codziennym. Odzyskany z: carriervibrating.com
- Krajowe Centrum Informacji o Pestycydach. (s.f.). Kwas borowy. Odzyskany z: npic.orst.edu
- Redakcja. (30 listopada 2017). Kwas borowy: właściwości i zastosowania tego związku chemicznego. Odzyskany z: acidos.info
- Chlorek sodu. (2019). Kwas borowy. Odzyskany z: chlorurosodio.com
- Hiszpańskie Towarzystwo Farmacji Szpitalnej. (s.f.). Kwas borowy. [PDF]. Odzyskany z: workgroups.sefh.es



Jeszcze bez komentarzy