
Właściwości, zastosowania i przykłady soli organicznych

Plik sole organiczne to gęsta liczba związków jonowych o niezliczonych właściwościach. Wcześniej pochodzą ze związku organicznego, który przeszedł transformację umożliwiającą mu przenoszenie ładunku, a także jego tożsamość chemiczna zależy od związanego z nim jonu.
Na poniższym obrazku przedstawiono dwa bardzo ogólne wzory chemiczne dla soli organicznych. Pierwszy z nich, R-AX, jest interpretowany jako związek, w którego strukturze węglowej atom lub grupa A niesie ładunek dodatni + lub ujemny (-).
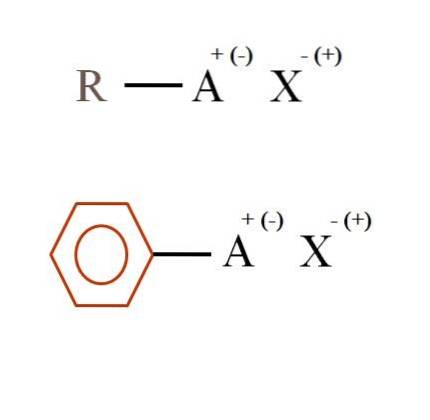
Jak widać, istnieje wiązanie kowalencyjne między R i A, RA, ale z kolei A ma formalny ładunek, który przyciąga (lub odpycha) jon X. Znak ładunku będzie zależał od natury A i środowisko chemiczne.
Gdyby A było dodatnie, z iloma znakami X mogłoby wchodzić w interakcje? Tylko z jednym, biorąc pod uwagę zasadę elektroobojętności (+ 1-1 = 0). Jaka jest jednak tożsamość X? Anion X może oznaczać CO3dwa-, wymagające dwóch kationów RA+; halogenek: F.-, Cl-, Br-, itp.; lub nawet inny związek RA-. Opcje są nieobliczalne.
Ponadto sól organiczna może mieć charakter aromatyczny, co ilustruje brązowy pierścień benzenowy. Benzoesan miedzi (II), (C6H.5GRUCHAĆ)dwaNa przykład Cu składa się z dwóch pierścieni aromatycznych z ujemnie naładowanymi grupami karboksylowymi, które oddziałują z kationem Cu.dwa+.
Indeks artykułów
- 1 Właściwości fizyczne i chemiczne
- 1.1 Wysokie masy cząsteczkowe
- 1.2 Substancje amfifilowe i środki powierzchniowo czynne
- 1.3 Wysokie temperatury wrzenia lub topnienia
- 1.4 Kwasowość i zasadowość
- 2 Zastosowania
- 3 Przykłady soli organicznych
- 3.1 Karboksylany
- 3.2 Diakylcupraty litu
- 3.3 Sole sulfoniowe
- 3.4 Sole oksoniowe
- 3.5 Sole amin
- 3.6 Sole diazoniowe
- 4 Odnośniki
Fizyczne i chemiczne właściwości
Z obrazu można powiedzieć, że sole organiczne składają się z trzech składników: organicznego, R lub Ar (pierścień aromatyczny), atomu lub grupy, która przenosi ładunek jonowy A i przeciwjonu X.
Tak jak tożsamość i strukturę chemiczną określają takie składniki, tak samo zależą od nich ich właściwości..
Na podstawie tego faktu można podsumować pewne ogólne właściwości, które spełnia zdecydowana większość tych soli..
Wysokie masy cząsteczkowe
Zakładając jedno lub wielowartościowe nieorganiczne aniony X, sole organiczne mają zwykle znacznie większe masy cząsteczkowe niż sole nieorganiczne. Dzieje się tak głównie za sprawą szkieletu węglowego, którego pojedyncze wiązania C-C i ich atomy wodoru składają się na dużą masę związku..
Dlatego R lub Ar są odpowiedzialne za ich duże masy cząsteczkowe..
Amfifiliki i środki powierzchniowo czynne
Sole organiczne są związkami amfifilowymi, to znaczy ich struktury mają zarówno hydrofilowe, jak i hydrofobowe końce..
Jakie są takie skrajności? R lub Ar reprezentują ekstremalnie hydrofobowe, ponieważ ich atomy C i H nie mają dużego powinowactwa do cząsteczek wody.
DO+(-), atom lub grupa niosąca ładunek jest końcem hydrofilowym, ponieważ przyczynia się do momentu dipolowego i oddziałuje z wodą, tworząc dipole (RA+ Odwa).
Kiedy regiony hydrofilowe i hydrofobowe są spolaryzowane, sól amfifilowa staje się środkiem powierzchniowo czynnym, substancją szeroko stosowaną do produkcji detergentów i demulgatory.
Wysoka temperatura wrzenia lub topnienia
Podobnie jak sole nieorganiczne, sole organiczne mają również wysokie temperatury topnienia i wrzenia ze względu na siły elektrostatyczne, które rządzą fazą ciekłą lub stałą..
Jednakże, ponieważ istnieje składnik organiczny R lub Ar, uczestniczą inne rodzaje sił Van der Waalsa (siły Londynu, dipol-dipol, wiązania wodorowe), które w pewien sposób konkurują z elektrostatyką..
Z tego powodu stałe lub ciekłe struktury soli organicznych są przede wszystkim bardziej złożone i zróżnicowane. Niektóre z nich mogą się nawet zachowywać ciekłe kryształy.
Kwasowość i zasadowość
Sole organiczne są na ogół silniejszymi kwasami lub zasadami niż sole nieorganiczne. Dzieje się tak, ponieważ A, na przykład w solach amin, ma ładunek dodatni ze względu na wiązanie z dodatkowym wodorem: A+-H. Następnie, w kontakcie z zasadą, oddaj proton, aby ponownie stał się związkiem neutralnym:
RA+H + B => RA + HB
H należy do A, ale jest napisane, ponieważ bierze udział w reakcji neutralizacji.
Z drugiej strony RA+ Może to być duża cząsteczka, niezdolna do tworzenia ciał stałych o wystarczająco stabilnej sieci krystalicznej z hydroksylowym lub hydroksylowym anionem OH-.
Kiedy tak jest, sól RA+O- zachowuje się jak mocna podstawa; nawet tak zasadowy jak NaOH lub KOH:
RA+O- + HC1 => RACl + HdwaLUB
Zauważ w równaniu chemicznym, że anion Cl- zastępuje OH-, tworząc sól RA+Cl-.
Aplikacje
Zastosowanie soli organicznych będzie się różnić w zależności od tożsamości R, Ar, A i X. Ponadto ich zastosowanie zależy również od rodzaju ciała stałego lub cieczy, które tworzą. Niektóre generały w tym zakresie to:
-Służą jako odczynniki do syntezy innych związków organicznych. RAX może działać jako „donor” dla łańcucha R, dodając go do innego związku, zastępując dobrą grupę opuszczającą.
-Są to środki powierzchniowo czynne, więc można je również stosować jako lubrykanty. W tym celu stosuje się sole metali z karboksylanów.
-Pozwalają na syntezę szerokiej gamy barwników.
Przykłady soli organicznych
Karboksylany
Kwasy karboksylowe reagują z wodorotlenkiem w reakcji zobojętniania, tworząc sole karboksylanowe: RCOO- M+; gdzie M.+ może być dowolnym kationem metalu (Na+, Pbdwa+, K.+, itp.) lub kation amonu NH4+.
Kwasy tłuszczowe to długołańcuchowe alifatyczne kwasy karboksylowe, mogą być nasycone i nienasycone. Wśród nasyconych znajduje się kwas palmitynowy (CH3(CHdwa)14COOH). To pochodzi z soli palmitynianowej, a kwas stearynowy (CH3(CHdwa)16COOH tworzy sól stearynianową. Mydła składają się z tych soli.
W przypadku kwasu benzoesowego C6H.5COOH (gdzie C.6H.5- jest pierścieniem benzenowym), reagując z zasadą tworzy sole benzoesanowe. We wszystkich karboksylanach grupa -COO- reprezentuje A (RAX).
Diakylcuprates litu
Diakylcupran litu jest przydatny w syntezie organicznej. Jego formuła to [R-Cu-R]-Li+, w którym atom miedzi ma ładunek ujemny. Tutaj miedź reprezentuje atom A na obrazie.
Sole sulfoniowe
Powstają w wyniku reakcji organicznego siarczku z halogenkiem alkilu:
RdwaS + R'X => RdwaR'S+X
W przypadku tych soli atom siarki ma dodatni ładunek formalny (S.+) przez trzy wiązania kowalencyjne.
Sole oksoniowe
Podobnie etery (utlenione analogi siarczków) reagują z węglowodorami, tworząc sole oksoniowe:
ROR '+ HBr <=> RO+HR '+ Br-
Kwaśny proton HBr jest kowalencyjnie związany z atomem tlenu w eterze (R.dwaLUB+-H), ładując go pozytywnie.
Sole amin
Aminy mogą być pierwszorzędowe, drugorzędowe, trzeciorzędowe lub czwartorzędowe, podobnie jak ich sole. Wszystkie z nich charakteryzują się tym, że atom H jest połączony z atomem azotu.
Zatem RNH3+X- jest solą aminy pierwszorzędowej; RdwaNHdwa+X-, amina drugorzędowa; R3NH+X-, trzeciorzędowa amina; i R.4N+X-, czwartorzędowa amina (czwartorzędowa sól amoniowa).
Sole diazoniowe
Wreszcie sole diazoniowe (RNdwa+X-) lub aryldiazonium (ArNdwa+X-), stanowią punkt wyjścia dla wielu związków organicznych, zwłaszcza barwników azowych.
Bibliografia
- Francis A. Carey. Chemia organiczna. (Wydanie szóste, strony 604-605, 697-698, 924). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. Chemia organiczna. Aminy. (Wydanie 10.). Wiley plus.
- Wikipedia. (2018). Sól (chemia). Zaczerpnięte z: en.wikipedia.org
- Steven A. Hardinger. (2017). Ilustrowany słownik chemii organicznej: sole. Odzyskany z: chem.ucla.edu
- Chevron Oronite. (2011). Karboksylany. [PDF]. Odzyskany z: oronite.com


Jeszcze bez komentarzy