
Reakcja zmydlania i substancje możliwe do uzyskania

Plik zmydlanie jest podstawową hydrolizą estru. Oznacza to, że ester reaguje nieodwracalnie z zasadą (NaOH lub KOH), tworząc alkohol oraz karboksylany sodu lub potasu. Słowo to oznacza „robienie mydła” i faktycznie jest to jedna z najstarszych reakcji chemicznych stosowanych przez ludzkość..
W czasach babilońskich, przy pomocy popiołu zbieranego z drewna i roślin oraz tłuszczów zwierzęcych, udoskonalili sztukę wytwarzania mydła. Dlaczego tłuszcz zwierzęcy? Powodem jest to, że jest bogaty w triestry glicerolu (trójglicerydy), a popiół drzewny jest źródłem potasu, podstawowego metalu.
W przeciwnym razie reakcja przebiega z mniejszą wydajnością, ale wystarczającą, aby odzwierciedlić jej wpływ na farby i niektóre powierzchnie. Tak jest w przypadku farb olejnych, gdzie pigmenty są mieszane z olejem (źródło estrów).
Indeks artykułów
- 1 Reakcja zmydlania
- 1.1 Mechanizm
- 1.2 Kinetyka
- 2 Substancje, które można uzyskać przez zmydlanie
- 2.1 Rozpuszczalnikowe działanie mydeł
- 3 Odnośniki
Reakcja zmydlania
Mechanizm
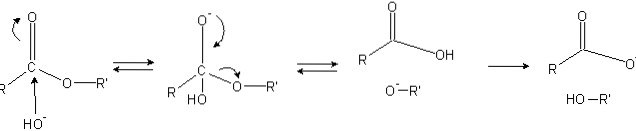
Estry mają grupę acylową (O = C-R), która jest podatna na ataki nukleofilowe, takie jak OH-.
Ponieważ atomy tlenu „kradną” gęstość elektronów z atomu węgla, jest on częściowo naładowany dodatnio, tym bardziej w przypadku estrów.
W konsekwencji ten dodatni ładunek przyciąga ujemne cząsteczki zdolne do dostarczania elektronów do atomu węgla, powodując atak nukleofilowy (lewa strona obrazu). W rezultacie powstaje tetraedryczny związek pośredni (druga cząsteczka od lewej do prawej).
Ujemny ładunek tlenu tetraedrycznego związku pośredniego jest produktem OH- otaczający. Ten ładunek ujemny jest następnie zdelokalizowany, dając początek grupie karbonylowej, a następnie „zmuszając” do zerwania wiązania C-OR '. Podobnie, ta delokalizacja prowadzi do powstania kwasu karboksylowego RCOOH i jonu alkoholanowego R'O-.
Wreszcie, ponieważ środowisko reakcji jest zasadowe, alkoholan deprotonuje cząsteczkę wody, a kwas karboksylowy reaguje z innym OH.- medium, generując produkty zmydlania.
Kinetyka
Szybkość reakcji zmydlania jest proporcjonalna do stężeń odczynników. Innymi słowy, zwiększając stężenie estru (RCOOR ') lub zasady (NaOH), reakcja będzie przebiegać szybciej.
Przekłada się to również w następujący sposób: stopień zmydlania jest pierwszego rzędu w stosunku do estru i pierwszego rzędu w stosunku do zasady. Powyższe można wyrazić za pomocą następującego równania matematycznego:
Prędkość = k [RCOOR '] [NaOH]
Gdzie k jest stałą lub współczynnikiem prędkości, który zmienia się w funkcji temperatury lub ciśnienia; to znaczy, im wyższe ciepło, tym wyższy stopień zmydlenia. Z tego powodu medium jest gotowane.
Ponieważ oba reagenty są pierwszego rzędu kinetycznego, cała reakcja jest drugiego rzędu.
W mechanizmie reakcji zmydlania tworzenie tetraedrycznego związku pośredniego wymaga ataku nukleofilowego, który obejmuje zarówno ester, jak i zasadę..
Zatem kinetyka drugiego rzędu znajduje odzwierciedlenie w tym fakcie, ponieważ interweniuje w decydującym (wolnym) etapie reakcji.
Substancje, które można uzyskać przez zmydlanie

Głównymi produktami zmydlania są alkohole i sole kwasów karboksylowych. W środowisku kwaśnym otrzymuje się odpowiednie RCOOH, otrzymywane przez zmydlanie tłuszczów i olejów, które są znane jako kwasy tłuszczowe.
Tak więc mydła składają się z soli kwasów tłuszczowych wytwarzanych przez zmydlanie. Czy wychodzisz z jakich kationów? Mogą być Na+, K.+, Mgdwa+, Wiara3+, itp.
Sole te są rozpuszczalne w wodzie, ale wytrącają się w wyniku działania NaCl dodanego do mieszaniny, który odwadnia mydło i oddziela je od fazy wodnej. Reakcja zmydlania triglicerydu wygląda następująco:
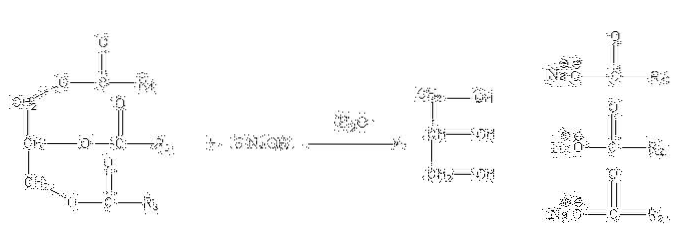
Gliceryna to alkoholowe „E”, a mydło to wszystkie sole powstających kwasów tłuszczowych. Tutaj każdy łańcuch boczny -R ma inną długość i stopień nienasycenia. W konsekwencji łańcuchy te decydują o różnicy między tłuszczami roślinnymi a olejami.
Kluczem do produkcji mydeł jest zatem dobór najlepszych tłuszczów i olejów, a dokładniej dobór różnych źródeł trójglicerydów..
Ta mydlana biała masa może zawierać w swojej strukturze barwniki i inne związki organiczne, nadając jej przyjemny aromat i jasne kolory. Stąd wachlarz możliwości jest ujarzmiany przez sztukę i powołanie w tym zawodzie..
Jednak reakcja zmydlania jest również drogą syntezy kwasów karboksylowych i alkoholi, które niekoniecznie mają związek z gliceryną lub mydłami..
Na przykład zasadowa hydroliza dowolnego estru, takiego jak zwykły octan etylu, spowoduje wytworzenie kwasu octowego i etanolu..
Rozpuszczalnikowe działanie mydeł

Sole kwasów tłuszczowych są rozpuszczalne w wodzie, ale nie w taki sam sposób, jak jony są solwatowane; to znaczy otoczona wodnistą kulą. W przypadku mydeł ich łańcuchy boczne -R teoretycznie zapobiegają ich rozpuszczaniu się w wodzie.
Dlatego, aby przeciwdziałać tej niewygodnej energetycznie pozycji, są one zorientowane w taki sposób, że łańcuchy te stykają się, tworząc apolarne jądro organiczne, natomiast głowy polarne skrajne (-COO- Na+), wchodzą w interakcje z cząsteczkami wody i tworzą „polarną powłokę”.
Powyższe zilustrowano na górnym obrazku, na którym pokazano ten typ struktury zwanej micelą.
„Czarne ogony” odpowiadają hydrofobowym łańcuchom, oplatającym się w organicznym jądrze chronionym przez szare kule. Te szare kule tworzą polarny pancerz, głowy -COO- Na+.
Zatem micele to skupiska (aglomeracje) soli kwasów tłuszczowych. Mogą w nich zawierać tłuszcz, który jest nierozpuszczalny w wodzie ze względu na swój niepolarny charakter..
Jak oni to robią? Zarówno łańcuchy tłuszczowy, jak i -R są hydrofobowe, więc oba mają ze sobą duże powinowactwo.
Kiedy micele otaczają tłuszcze, woda wchodzi w interakcję z polarną powłoką, umożliwiając rozpuszczalność mydła. Podobnie micele są naładowane ujemnie, powodując wzajemne odpychanie, a tym samym generując dyspersję tłuszczu..
Bibliografia
- Dr Anne Marie Helmenstine (03 października 2017). Definicja i reakcja zmydlenia. Pobrane 24 kwietnia 2018 r.Z: thinkco.com
- Francis A. Carey. Chemia organiczna. Kwasy karboksylowe. (wydanie szóste, strony 863-866). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. Chemia organiczna. Lipidy (wydanie dziesiąte, strony 1056-1058). Wiley plus.
- Wikipedia. (2018). Zmydlanie. Pobrane 24 kwietnia 2018 r. Z: en.wikipedia.org
- Boyd C. (27 lutego 2015). Zrozum chemię i historię mydła. Pobrane 24 kwietnia 2018 r. Z: chemservice.com
- Luca Laghi. (27 marca 2007). Zmydlanie. Pobrane 24 kwietnia 2018 z: commons.wikimedia.org
- Amanda Crochet. (12 maja 2015). Micelle (skala szarości). Pobrane 24 kwietnia 2018 z: commons.wikimedia.org



Jeszcze bez komentarzy