
Proces solwatacji, różnice z hydratacją i przykłady

Plik rozwiązanie to fizyczne i chemiczne wiązanie między cząsteczkami substancji rozpuszczonej i rozpuszczalnika w roztworze. Różni się od pojęcia rozpuszczalności tym, że nie ma równowagi termodynamicznej między ciałem stałym a jego rozpuszczonymi cząstkami..
Związek ten jest odpowiedzialny za „znikanie” rozpuszczonych substancji stałych na oczach widzów; kiedy w rzeczywistości cząsteczki stają się bardzo małe i zostają „pokryte” warstwami cząsteczek rozpuszczalnika, co uniemożliwia ich obserwację.
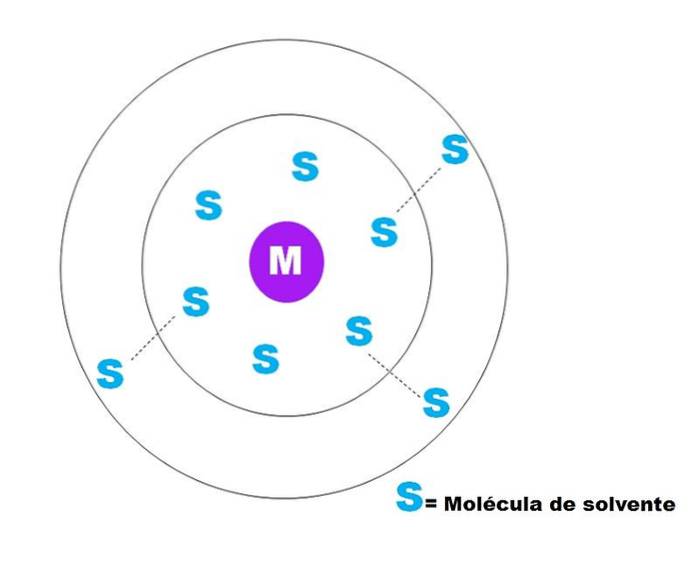
Na powyższym obrazku przedstawiono bardzo ogólny szkic solwatacji cząstki M. M może być jonem (M+) lub cząsteczkę; a S jest cząsteczką rozpuszczalnika, którym może być dowolny związek w stanie ciekłym (chociaż może być również gazowy).
Zauważ, że M jest otoczona przez sześć cząsteczek S, które tworzą to, co jest znane jako podstawowa sfera solwatacji. Inne cząsteczki S z większej odległości oddziałują siłami Van der Waalsa z tymi pierwszymi, tworząc sferę wtórnej solwatacji i tak dalej, aż pewne sortowanie nie jest oczywiste..
Indeks artykułów
- 1 Proces solwatacji
- 2 Aspekty energetyczne
- 3 Oddziaływania międzycząsteczkowe
- 4 Różnice w nawadnianiu
- 5 przykładów
- 5.1 Chlorek wapnia
- 5.2 Mocznik
- 5.3 Azotan amonu
- 6 Odnośniki
Proces solwatacji
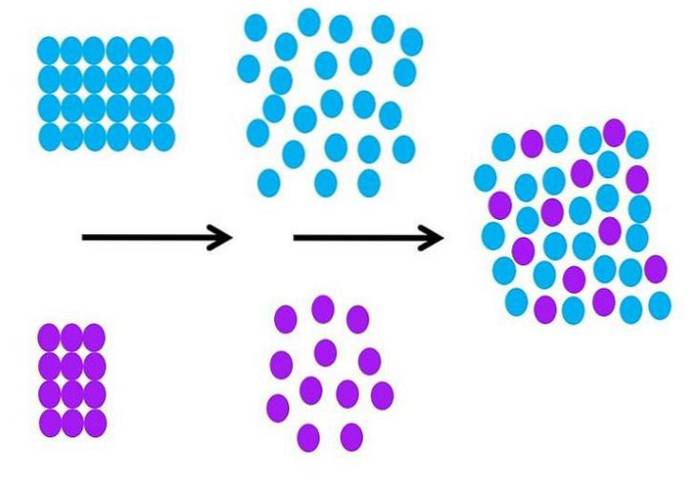
Jak wygląda proces solwatacji z molekularnego punktu widzenia? Powyższy obraz podsumowuje niezbędne kroki.
Początkowo uporządkowane są cząsteczki rozpuszczalnika, które są koloru niebieskiego, wszystkie oddziałują ze sobą (S-S); a fioletowe cząsteczki substancji rozpuszczonej (jony lub cząsteczki) robią to samo z silnymi lub słabymi oddziaływaniami M-M.
Aby doszło do solwatacji, zarówno rozpuszczalnik, jak i substancja rozpuszczona muszą rozszerzać się (druga czarna strzałka), aby umożliwić interakcje substancja rozpuszczona-rozpuszczalnik (M-S)..
To z konieczności implikuje zmniejszenie interakcji substancji rozpuszczonej i substancji rozpuszczonej oraz rozpuszczalnika i rozpuszczalnika; spadek, który wymaga energii, dlatego ten pierwszy krok ma charakter endotermiczny.
Gdy substancja rozpuszczona i rozpuszczalnik rozszerzą się molekularnie, oba mieszają się i zamieniają miejscami w przestrzeni. Każde fioletowe kółko na drugim obrazie można porównać do tego na pierwszym obrazie.
Na obrazie można wyszczególnić zmianę stopnia uporządkowania cząstek; uporządkowane na początku i nieuporządkowane na końcu. W konsekwencji ostatni etap jest egzotermiczny, ponieważ tworzenie nowych oddziaływań M-S stabilizuje wszystkie cząstki w roztworze..
Aspekty energetyczne
Za procesem solwatacji należy wziąć pod uwagę wiele aspektów energetycznych. Po pierwsze: interakcje S-S, M-M i M-S.
Kiedy interakcje M-S, to znaczy między substancją rozpuszczoną a rozpuszczalnikiem, są znacznie większe (silne i stabilne) w porównaniu z oddziaływaniami poszczególnych składników, mówimy o egzotermicznym procesie solwatacji; w związku z tym energia jest uwalniana do ośrodka, co można zweryfikować, mierząc wzrost temperatury za pomocą termometru.
Jeśli, przeciwnie, interakcje M-M i S-S są silniejsze niż interakcje M-S, to do „ekspansji” będą potrzebować więcej energii niż zyskują po zakończeniu solwatacji..
Mówi się wtedy o endotermicznym procesie solwatacji. W takim przypadku odnotowuje się spadek temperatury, lub co jest tym samym, chłodzenie otoczenia.
Istnieją dwa podstawowe czynniki, które decydują o tym, czy substancja rozpuszczona rozpuszcza się w rozpuszczalniku. Pierwszą jest zmiana entalpii roztworu (ΔHdis), jak właśnie wyjaśniono, a druga to zmiana entropii (ΔS) między substancją rozpuszczoną a substancją rozpuszczoną. Ogólnie, ΔS jest związane ze wzrostem zaburzeń, również wspomnianych powyżej.
Oddziaływania międzycząsteczkowe
Wspomniano, że solwatacja jest wynikiem fizycznego i chemicznego wiązania między substancją rozpuszczoną a rozpuszczalnikiem; Jednak jak dokładnie są te interakcje lub związki?
Jeśli substancją rozpuszczoną jest jon, M+, zachodzą tak zwane interakcje jonowo-dipolowe (M.+-S); a jeśli jest to cząsteczka, będą oddziaływać dipol-dipol lub siły rozpraszające w Londynie.
Mówiąc o oddziaływaniach dipol-dipol, mówi się, że istnieje trwały moment dipolowy w M i S.W ten sposób region M bogaty w δ- elektrony oddziałuje z regionem S. ubogim w elektrony δ +. ze wszystkich tych interakcji jest tworzenie kilku sfer solwatacji wokół M..
Dodatkowo istnieje inny rodzaj interakcji: koordynacyjna. Tutaj cząsteczki S tworzą wiązania koordynacyjne (lub celujące) z M, tworząc różne geometrie.
Podstawową zasadą zapamiętywania i przewidywania powinowactwa między substancją rozpuszczoną a rozpuszczalnikiem jest: równy rozpuszcza się równy. Dlatego substancje polarne bardzo łatwo rozpuszczają się w równie polarnych rozpuszczalnikach; i substancje niepolarne, rozpuszczają się w rozpuszczalnikach niepolarnych.
Różnice w nawodnieniu
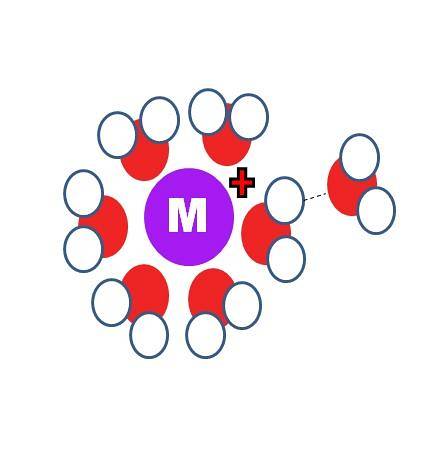
Czym różni się solwatacja od hydratacji? Dwa identyczne procesy, z tym wyjątkiem, że cząsteczki S na pierwszym obrazie zostały zastąpione cząsteczkami wody, H-O-H.
Na górnym obrazku widać kation M.+ otoczony sześcioma cząsteczkami H.dwaO. Zauważ, że atomy tlenu (w kolorze czerwonym) są skierowane w stronę ładunku dodatniego, ponieważ jest on najbardziej elektroujemny i dlatego ma najwyższą ujemną gęstość δ-.
Za pierwszą sferą hydratacyjną inne cząsteczki wody są zgrupowane wokół wiązań wodorowych (OHdwa-Odwa). To są interakcje jon-dipol. Jednak cząsteczki wody mogą również tworzyć wiązania koordynacyjne z dodatnim centrum, zwłaszcza jeśli jest metaliczne..
Tak więc słynne aquakompleksy M (OHdwa)n. Ponieważ na obrazie n = 6, sześć cząsteczek jest zorientowanych wokół M w oktaedrze koordynacyjnym (wewnętrzna sfera hydratacji). W zależności od rozmiaru M+, wielkość jego ładunku i dostępność elektroniczna, ta sfera może być mniejsza lub większa.
Woda jest prawdopodobnie najbardziej zaskakującym rozpuszczalnikiem ze wszystkich: rozpuszcza niezmierzoną ilość substancji rozpuszczonych, jest rozpuszczalnikiem zbyt polarnym i ma nienormalnie wysoką stałą dielektryczną (78,5 K).
Przykłady
Poniżej wymieniono trzy przykłady solwatacji w wodzie.
Chlorek wapnia
Rozpuszczenie chlorku wapnia w wodzie uwalnia ciepło w postaci solwatu z kationami Ca.dwa+ i aniony Cl-. Okołodwa+ otacza się liczbą cząsteczek wody równą lub większą niż sześć (Cadwa+-Odwa).
Podobnie Cl- jest otoczony atomami wodoru, region δ + wody (Cl--H.dwaLUB). Uwolnione ciepło można wykorzystać do stopienia mas lodu.
Mocznik
W przypadku mocznika jest to cząsteczka organiczna o strukturze HdwaN-CO-NHdwa. Po solwatacji cząsteczki H.dwaLub tworzy wiązania wodorowe z dwiema grupami aminowymi (-NHdwa-Odwa) oraz z grupą karbonylową (C = O-HdwaLUB). Te interakcje są odpowiedzialne za jego doskonałą rozpuszczalność w wodzie..
Podobnie jego rozpuszczanie jest endotermiczne, to znaczy chłodzi zbiornik na wodę, w którym jest dodawany.
Azotan amonowy
Azotan amonu, podobnie jak mocznik, jest substancją rozpuszczoną, która chłodzi roztwór po solwatacji jego jonów. NH4+ jest solwatowany w sposób podobny do Cadwa+, chociaż prawdopodobnie dlatego, że ma geometrię czworościenną, ma mniej cząsteczek H.dwaAlbo wokół ciebie; i NIE3- jest solwatowany w taki sam sposób jak aniony Cl- (Odwa-LUBdwaNIE- H.dwaLUB).
Bibliografia
- Glasstone S. (1970). Traktat o chemii i fizyce. Aguilar, SA, Madryt, Hiszpania.
- Whitten, Davis, Peck & Stanley. Chemia. (8th ed.). CENGAGE Learning.
- Ira N. Levine. (2014). Zasady fizykochemii. Szósta edycja. Mc Graw Hill.
- Słownik Chemicool. (2017). Definicja solwacji. Źródło: chemicool.com
- Belford R. (s.f.). Procesy solwatacji. Chemia LibreTexts. Źródło: chem.libretexts.org
- Wikipedia. (2018). Solwacja. Odzyskane z: en.wikipedia.org
- Hardinger A. Steven. (2017). Ilustrowany słownik chemii organicznej: solwatacja. Odzyskany z: chem.ucla.edu
- Surf Guppy. (s.f.). Proces solwatacji. Odzyskany z: surfguppy.com


Jeszcze bez komentarzy