
Charakterystyka i zastosowanie fosforanu dihydroksyacetonu (DHAP)
Plik fosforan dihydroksyacetonu Jest to związek chemiczny w skrócie DHAP. Jest pośrednikiem w niektórych szlakach metabolicznych organizmów żywych, takich jak degradacja glikolityczna lub glikoliza, a także w cyklu Calvina u roślin.
Biochemicznie DHAP jest produktem działania enzymu aldolazy na fruktozo-1,6-bisfosforan (FBP), który powoduje rozkład aldolityczny, w wyniku którego powstają dwa trójwęglowe związki: DHAP i gliceraldehydo-3-fosforan (GAP).
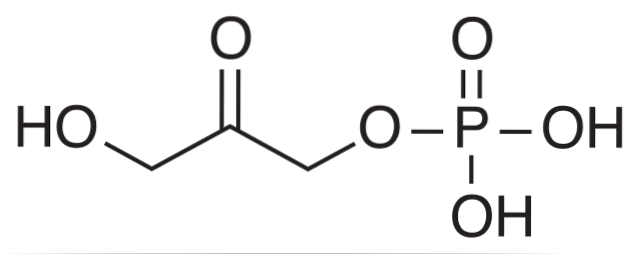
W cyklu Calvina aldolaza przeprowadza reakcję odwrotną, kondensując cząsteczki DHAP z cząsteczkami GAP, tworząc heksozę..
Indeks artykułów
- 1 Funkcje
- 2 DHAP w glikolizie
- 2.1 Reakcja aldolazy
- 2.2 Reakcja TIM
- 3 DHAP w cyklu Calvina
- 4 DHAP w glukoneogenezie
- 5 Referencje
Charakterystyka
DHAP jest klasyfikowany w cząsteczkach zwanych ketotriozami. Są to monosacharydy zbudowane z łańcucha trzech atomów węgla (triozy) z grupą karbonylową na centralnym węglu (C2).
GAP i DAHP są funkcjonalnymi izomerami i stanowią najprostsze węglowodany w biologicznie aktywnych cząsteczkach organicznych.
Chociaż struktura chemiczna wielu powszechnych węglowodanów, takich jak GAP i DHAP, to aldehydy i ketony, określa się je terminem węglowodany, odnosząc się do bezpośrednich pochodnych sacharydów.
DHAP w glikolizie
W glikolizie szereg reakcji powoduje degradację glukozy do pirogronianu. Ta degradacja zachodzi stopniowo w 10 kolejnych etapach, w których interweniują różne enzymy i wytwarzane są różne półprodukty, z których wszystkie są fosforylowane..
DHAP pojawia się w glikolizie w czwartej reakcji tego procesu, polegającej na rozpadzie FBP na dwa węglowodany o trzech węglach (triozy), z których tylko GAP kontynuuje sekwencję glikolizy, podczas gdy DHAP musi zostać przekształcony w GAP, aby podążać tą drogą.
Ta reakcja jest katalizowana przez aldolazę (aldolaza bisfosforanu fruktozy), która przeprowadza rozszczepienie aldolowe między atomami węgla C3 i C4 FBP.
Ta reakcja zachodzi tylko wtedy, gdy dzielona heksoza ma grupę karbonylową przy C2 i hydroksyl przy C4. Z tego powodu izomeryzacja glukozo-6-fosforanu (G6P) do fruktozo-6-fosforanu (F6P) zachodzi wcześniej..
DHAP bierze również udział w piątej reakcji glikolizy, polegającej na jego izomeryzacji do GAP przez enzym izomerazę triozofosforanową lub TIM. W tej reakcji kończy się pierwsza faza degradacji glukozy..
Reakcja aldolazy
W rozkładzie aldolowym powstają dwa półprodukty, w których DHAP stanowi 90% mieszaniny w równowadze.
Istnieją dwa typy aldolaz: a) aldolaza typu I jest obecna w komórkach zwierzęcych i roślinnych i charakteryzuje się tworzeniem zasady Schiffa pomiędzy aktywnym miejscem enzymatycznym a karbonylem FBP. b) Aldolaza typu II występuje w niektórych bakteriach i grzybach, zawiera metal w miejscu aktywnym (zwykle Zn).
Rozszczepienie aldolowe rozpoczyna się od przylegania podłoża do centrum aktywnego i usunięcia protonu z grupy β-hydroksylowej, tworząc protonowaną zasadę Schiffa (kation iminiowy). Rozkład węgli C3 i C4 powoduje uwolnienie GAP i utworzenie półproduktu zwanego enaminą..
Następnie enamina jest stabilizowana, w wyniku czego powstaje kation iminiowy, który ulega hydrolizie, przy czym ostatecznie uwalnia się DHAP i regeneruje wolny enzym.
W komórkach z aldolazą typu II nie zachodzi tworzenie zasady Schiffa, będącej dwuwartościowym kationem metalicznym, na ogół Zndwa+, ten, który stabilizuje pośrednią enaminę w celu uwolnienia DHAP.
Reakcja TIM
Jak wspomniano, równowagowe stężenie DHAP jest wyższe niż GAP, tak że cząsteczki DHAP są przekształcane w GAP, gdy ten ostatni jest używany w następnej reakcji glikolizy..
Ta przemiana zachodzi dzięki enzymowi TIM. Jest to piąta reakcja procesu degradacji glikolitycznej, w której węgle C1 i C6 glukozy stają się węglami C3 GAP, a węgle C2 i C5 stają się C2 i C3 i C4 glukozy stają się C1 GAP.
Enzym TIM jest uważany za „enzym doskonały”, ponieważ dyfuzja kontroluje szybkość reakcji, co oznacza, że produkt powstaje tak szybko, jak miejsce aktywne enzymu i jego substrat łączą się..
W reakcji przemiany DHAP w GAP powstaje półprodukt zwany enediolem. Ten związek jest zdolny do oddawania protonów grup hydroksylowych reszcie miejsca aktywnego enzymu TIM..
DHAP w cyklu Calvina
Cykl Calvina to cykl fotosyntetycznej redukcji węgla (PCR), który stanowi ciemną fazę procesu fotosyntezy u roślin. Na tym etapie produkty (ATP i NADPH) otrzymane w lekkiej fazie procesu wykorzystywane są do produkcji węglowodanów..
W tym cyklu powstaje sześć cząsteczek GAP, z których dwie są przekształcane w DHAP przez izomeryzację, dzięki działaniu enzymu TIM, w reakcji odwrotnej do tej, która zachodzi podczas degradacji glikolizy. Ta reakcja jest odwracalna, chociaż równowaga, w przypadku tego cyklu i, w przeciwieństwie do glikolizy, jest przesunięta w kierunku konwersji GAP do DHAP.
Te cząsteczki DHAP mogą następnie podążać dwoma ścieżkami, jednym jest kondensacja aldolowa katalizowana przez aldolazę, w której kondensuje się z cząsteczką GAP, tworząc FBP.
Inną reakcją, jaką może przyjąć jeden z DHAP, jest hydroliza fosforanów katalizowana przez bisfosfatazę sedoheptulozową. Na tej ostatniej drodze reaguje z erytrozą, tworząc sedoheptulozę 1,7-bisfosforan.
DHAP w glukoneogenezie
Podczas glukoneogenezy niektóre związki nieglukidowe, takie jak pirogronian, mleczan i niektóre aminokwasy, są przekształcane w glukozę. W tym procesie DHAP pojawia się ponownie poprzez izomeryzację cząsteczki GAP pod działaniem TIM, a następnie poprzez kondensację aldolową staje się FBP.
Bibliografia
- Bailey, P. S., & Bailey, C. A. (1998). Chemia organiczna: pojęcia i zastosowania. Ed. Pearson Education.
- Devlin, T. M. (1992). Podręcznik biochemii: z korelacjami klinicznymi. John Wiley & Sons, Inc..
- Garrett, R. H. i Grisham, C. M. (2008). Biochemia. Ed. Thomson Brooks / Cole.
- Nelson, D. L. i Cox, M. M. (2006). Lehninger Principles of Biochemistry, wydanie 4. Ed Omega. Barcelona.
- Rawn, J. D. (1989). Biochemia (Nr 577,1 RAW). Ed. Interamericana-McGraw-Hill
- Voet, D. i Voet, J. G. (2006). Biochemia. Panamerican Medical Ed..

Jeszcze bez komentarzy