
Struktura, właściwości, synteza siarczanu żelaza (FeSO4)

Plik Siarczan żelaza to sól nieorganiczna, której wzór chemiczny to FeSO4. Składa się z krystalicznego ciała stałego o zmiennym kolorze, otrzymywanego przemysłowo jako produkt uboczny obróbki stali..
Występuje w przyrodzie w różnych formach, z których najczęstszą jest heptahydrat siarczanu żelazawego FeSO47HdwaO („zielony witriol”, obecny w mineralnym melentericie). Ten hydrat można łatwo odróżnić po niebieskawo-zielonym kolorze jego kryształów (dolny obraz). Inne hydraty mają ogólny wzór FeSO4XHdwaLub, gdzie x waha się od 1 do 7.

Heptahydrat siarczanu żelazawego traci cząsteczki wody podczas ogrzewania i może zostać przekształcony w inne formy siarczanu żelazawego; w ten sposób po podgrzaniu do 57 ° C traci trzy cząsteczki wody i przekształca się w tetrahydrat siarczanu żelazawego. Ile w sumie możesz stracić? Siedem cząsteczek wody, czyli za dużo wody.
Siarczan żelazawy jest stosowany w leczeniu i zapobieganiu niedokrwistości z niedoboru żelaza. Może jednak mieć działanie toksyczne, dlatego należy uważać przy jego dawkowaniu.
Z drugiej strony ta sól żelaza ma liczne zastosowania i zastosowania, które obejmują barwienie materiałów włókienniczych i skóry; chemiczny środek redukujący; dozymetr promieniowania; środek do konserwacji drewna. Znajduje również zastosowanie w profilaktyce chlorozy u roślin oraz w procesach grawerowania i litografii..
FeSO4 może utleniać się w powietrzu do siarczanu żelaza (III), Fedwa(POŁUDNIOWY ZACHÓD4)3 w tempie, które może wzrosnąć pod wpływem temperatury, światła lub wzrostu pH.
Wiele fizycznych i chemicznych właściwości siarczanu żelazawego, takich jak rozpuszczalność w wodzie, temperatura topnienia, rodzaj tworzonych kryształów i gęstość, zależy od liczby cząsteczek wody zawartych w kryształach; to znaczy jego hydratów.
Indeks artykułów
- 1 Struktura siarczanu żelaza
- 1.1 Kwasowość
- 2 Właściwości fizyczne i chemiczne
- 2.1 Nazwy
- 2.2 Wzór cząsteczkowy
- 2.3 Masa cząsteczkowa
- 2.4 Wygląd fizyczny
- 2.5 Zapach
- 2.6 Gęstość
- 2.7 Temperatura topnienia
- 2.8 Rozpuszczalność w wodzie
- 2.9 Rozpuszczalność w alkoholu
- 2.10 Prężność par
- 2.11 Współczynnik załamania światła
- 2.12 Stabilność
- 2.13 Rozkład
- 2.14 Reakcje
- 3 Synteza
- 3.1 Z wełny stalowej
- 3.2 Z pirytu
- 4 Ryzyka
- 5 zastosowań
- 5.1 W rolnictwie
- 5.2 Jako odczynnik i w przemyśle
- 5.3 W medycynie i do wzbogacania żywności
- 5.4 Inne
- 6 Odnośniki
Struktura siarczanu żelaza
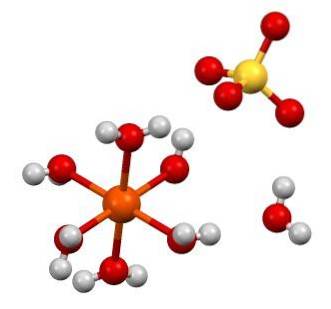
Wzór chemiczny FeSO4 podkreśla, że sól ta składa się z jonów Fedwa+ A więc4dwa- w stosunku 1: 1. Oba jony oddziałują siłami elektrostatycznymi w taki sposób, że są ułożone w rombowy układ kryształów; co logicznie odpowiada bezwodnej soli.
Z drugiej strony na górnym obrazku pokazano strukturę FeSO47HdwaO. Pomarańczowa kula reprezentuje kation Fedwa+, który, jak widać, koordynuje się z sześcioma cząsteczkami wody, tworząc ośmiościan. Ciężar wiarydwa+ przyciąga anion SO4dwa-, a to z kolei, jeśli zostanie zaobserwowane, tworzy wiązanie wodorowe z siódmą cząsteczką wody.
Siódma cząsteczka wody (ta, która jest odległa od ośmiościanu) również tworzy inne wiązanie wodorowe z inną cząsteczką wody należącą do sąsiedniego ośmiościanu. W wyniku tych interakcji kryształ zmienia się z rombowego w jednoskośny..
Jak kryształy FeSO4 bezwodny hydrat, aniony SO4dwa- wokół wiarydwa+ są zastąpione cząsteczkami H.dwaO. Te podstawienia zakłócają elektrony re żelazo, zmuszając je do przejścia przez różne poziomy energii; które są odpowiedzialne za zmiany koloru między białym, niebieskawo-zielonym.
Kwasowość
Niektóre aniony SO4dwa- mogą być protonowane jako produkt kwaśnego środowiska. W konsekwencji w kryształach FeSO47HdwaLub mogą istnieć cząsteczki H.dwapołudniowy zachód4 jeśli pH jest bardzo kwaśne; dlatego dotknięcie tych pięknych kryształów w takich warunkach może spowodować poważne oparzenia..
Fizyczne i chemiczne właściwości
Nazwy
Siarczan żelazawy lub siarczan żelaza (II)
Formuła molekularna
-Bezwodny siarczan żelazawy (FeSO4)
-Heptahydrat siarczanu żelazawego (FeSO4.7HdwaLUB)
Waga molekularna
Zmienia się w zależności od stopnia uwodnienia siarczanu. Na przykład heptahydrat siarczanu żelaza ma masę cząsteczkową 278,02 g / mol; podczas gdy bezwodna ma masę cząsteczkową 151,91 g / mol.
Wygląd fizyczny
Zależy również od stopnia nawodnienia. Na przykład postać bezwodna ma białe kryształy rombowe; podczas gdy w postaci siedmiowodnej kryształy są jednoskośne, niebiesko-zielonkawe.
Zapach
Toaleta
Gęstość
Bezwodny siarczan żelazawy jest najgęstszą formą soli (3,65 g / cm)3). Z drugiej strony forma heptahydratu jest najmniej gęsta (1,895 g / cm)3).
Temperatura topnienia
Podobnie zmienia się to w zależności od stopnia nawodnienia. Forma bezwodna ma temperaturę topnienia 680ºC (1856ºF, 973 K), a postać heptahydratu 60-64ºC (140-147ºF, 333-337 K).
Rozpuszczalność w wodzie
-Postać jednowodna: 44,69 g / 100 ml wody (77 ºC)
-Postać heptawodzianu 51,35 g / 100 ml wody (54 ºC).
Rozpuszczalność w alkoholu
Nierozpuszczalny.
Ciśnienie pary
1,95 kPa (postać siedmiowodna)
Współczynnik załamania światła
1591 (monohydrat) i 1471 (heptahydrat).
Stabilność
W powietrzu może szybko się utleniać i pokrywać się żółto-brązowym kolorem, co wskazuje na obecność kationu Fe.3+. Szybkość utleniania zwiększa się przez dodanie alkaliów lub wystawienie na działanie światła..
Rozkład
Po podgrzaniu do rozkładu wydziela toksyczne opary dwutlenku siarki i trójtlenku siarki, pozostawiając jako pozostałość czerwonawy tlenek żelaza..
Reakcje
Jest to środek redukujący, który działa na kwas azotowy redukując go do tlenku azotu. Podobnie redukuje chlor do chlorków, a toksyczne formy chromu obecne w cemencie do chromu (III), o mniejszej toksyczności.
Synteza
Z wełny stalowej
Siarczan żelazawy jest wytwarzany w reakcji stali (Fe) z kwasem siarkowym. W opisanej metodzie stosuje się następującą procedurę: stal stosowana jest w postaci wełny stalowej, którą wcześniej odtłuszczono acetonem..
Wełna stalowa jest następnie umieszczana w szklanej zlewce i całkowicie pokryta 30-40% kwasem siarkowym, umożliwiając trawienie kwasem przez kilka godzin; aż wełna stalowa zniknie. Można dodać więcej wełny stalowej i procedurę kilkakrotnie powtórzyć.
Zielone kryształy, które mogły się utworzyć, są ponownie rozpuszczane za pomocą wody zakwaszonej do pH 1-2 kwasem siarkowym. Roztwór ten przesączono przez bibułę filtracyjną i pH wyregulowano przez dodanie węglanu sodu. Roztwór jest przechowywany, aby uniknąć jego kontaktu z tlenem, a tym samym zniechęcić do utleniania Fedwa+ do wiary3+
Następnie przesącz poddaje się odparowaniu w temperaturze 80-90 ° C. Zabieg przeprowadza się w kapsułkach Pietri umieszczonych na płycie grzewczej. Następnie zbiera się utworzone zielone kryształy, które można przenieść do eksykatora w celu całkowitego odwodnienia..
Z pirytu
Siarczan żelazawy jest również wytwarzany przez utlenianie pirytu (FeSdwa).
2 FeSdwa + 7 Odwa + 2 godzdwaO => 2 FeSO4 + 2 godzdwapołudniowy zachód4
Ryzyka
Wdychanie FeSO4 powoduje podrażnienie nosa, gardła i płuc. Kontakt fizyczny z tą solą może powodować podrażnienie skóry i oczu; Ponadto długotrwały kontakt z tym ostatnim może spowodować brązowawą plamę i uszkodzenie oczu..
Wielokrotne przyjmowanie może powodować nudności, wymioty, ból brzucha, zaparcia i nieregularne wypróżnienia..
Objawy zatrucia siarczanem żelazawym obejmują: czarne lub krwawe stolce; niebieskawa skóra i paznokcie; zmiany objętości wydalanego moczu; półomdlały; suchość w ustach lub oczach; ból w klatce piersiowej; jeść; Niewydolność oddechowa.
Ponadto mogą wystąpić szybkie i nieregularne bicie serca, zwiększone pragnienie i głód, niezwykła bladość i duszność..
Zmiana krzepnięcia wskazuje na zatrucie siarczanem żelazawym, przy czym obserwuje się wydłużenie czasu trwania trombiny, protrombiny i częściowej tromboplastyny..
Przeprowadzone badania nad wpływem siarczanu żelazawego na izolowane mięśnie serca królików pozwoliły zaobserwować, że powoduje on zmniejszenie maksymalnego napięcia wytwarzanego przez badane mięśnie sercowe, a także maksymalne tempo rozwoju napięcia..
Aplikacje
W rolnictwie
-Jest stosowany jako pestycyd do zwalczania szczypania pszenicy i gnicia drzew owocowych.
-Stosowany jest w leczeniu chlorozy, choroby charakteryzującej się żółtawym kolorem liści, spowodowanym zasadowością gleby..
-Siarczan żelazawy kontroluje zasadowość, obniżając pH gleby.
- Usuwa mech i pielęgnuje trawnik.
Jako odczynnik i w przemyśle
W ramach zastosowań FeSO4 jako odczynnik, aw przemyśle są:
-Odczynnik analityczny
-Surowiec do otrzymywania ferrytu i magnetycznego tlenku żelaza
-Składnik do produkcji nieorganicznego niebieskiego pigmentu
-Odczynnik redukujący kwas azotowy, chlor i chrom
-Przy produkcji innych siarczanów
-Stosowany jest w wannach do galwanizacji żelazem
-Środek do konserwacji drewna
-W wytrawionych aluminium
-Jakościowa analiza azotanów (brązowożółty test utleniania Fedwa+)
-Katalizator polimeryzacji
-Jest używany jako prekursor do syntezy innych żelazów
-Jest używany w przemyśle jako środek do usuwania plam
-W produkcji barwnika żelaza
-Zaprawiony w barwieniu wełny
-Aby nadać drewnu klonowego srebrny kolor
-Katalizator żelazowy w reakcji Fentona
W medycynie i do wzbogacania żywności
Stosowany jest w leczeniu niedokrwistości z niedoboru żelaza, stosując dawkę 150-300 mg siarczanu żelazawego trzy razy dziennie, co powoduje odczuwalny wzrost stężenia hemoglobiny w ciągu tygodnia leczenia..
Zalecany jest również do stosowania u kobiet w ciąży jako uzupełnienie ich diety. Siarczan żelazawy jest stosowany jako środek ściągający w gojeniu ran u bydła..
Inni
Służy do oczyszczania ścieków metodą flokulacji, a także do usuwania fosforanów z tych wód. Do identyfikacji rodzajów grzybów stosuje się heptahydrat siarczanu żelazawego.
Bibliografia
- CR Scientific. (s.f.). Laboratoryjne przygotowanie siarczanu żelazawego. Odzyskany z: crscientific.com
- Werner H. Baur. (1964). O krystalochemii wodzianów soli. III. Wyznaczanie struktury krystalicznej FeSO4.7HdwaLub (melanteryt). Acta Cryst. doi.org/10.1107/S0365110X64003000
- PubChem. (2019). Heptahydrat siarczanu żelazawego. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Marks Lynn. (19 grudnia 2014). Co to jest siarczan żelaza (Feosol)? Każde zdrowie. Odzyskany z: dailyhealth.com
- Wikipedia. (2019). Siarczan żelaza (II). Odzyskane z: en.wikipedia.org



Jeszcze bez komentarzy