
Struktura, właściwości, wytwarzanie, zastosowania siarczku wapnia (CaS)

Plik siarczek wapnia Jest to nieorganiczna substancja stała utworzona przez pierwiastek wapnia (Ca) i pierwiastek siarki (S), wzór chemiczny to CaS. Jest to żółtawo-biała substancja stała rozpuszczalna w wodzie, występująca w naturze w niektórych wulkanach i niektórych meteorytach w postaci minerału zwanego oldhamitem..
Kiedy CaS rozpuszcza się w wodzie, tworzy różne związki dzięki jonowi siarczkowemu Sdwa- staje się jonowym SH- i powstają jony OH-. Powstały roztwór ma odczyn zasadowy. Ten związek jest używany jako baza dla związków luminescencyjnych lub wytwarzających światło widzialne w określonych warunkach. Materiały te są również używane w farbach luminescencyjnych.

CaS został uznany za możliwy lek do leczenia problemów z sercem i naczyniami krwionośnymi, takich jak nadciśnienie lub wysokie ciśnienie krwi, które są chorobą dotykającą dużą część światowej populacji.
W przypadku siarczku wapnia można otrzymać inne związki, takie jak azotan wapnia i węglan wapnia. Należy obchodzić się z nim ostrożnie iw kontakcie z wilgotnością atmosfery może wytwarzać H.dwaS, który jest bardzo toksyczny.
Indeks artykułów
- 1 Struktura
- 2 Nazewnictwo
- 3 Właściwości fizyczne
- 3.1 Stan fizyczny
- 3.2 Masa cząsteczkowa
- 3.3 Temperatura topnienia
- 3.4 Gęstość
- 3.5 Rozpuszczalność
- 4 Właściwości chemiczne
- 4.1 Roztwór wodny
- 4.2 Związki obecne po rozpuszczeniu w wodzie
- 4.3 Reakcja z kwasami
- 4.4 Inne reakcje
- 5 Otrzymywanie
- 5.1 Obecność w przyrodzie
- 6 zastosowań
- 6.1 W materiałach świecących
- 6.2 W medycynie
- 6.3 Przy otrzymywaniu innych związków
- 6.4 Inne aplikacje
- 7 Ryzyka
- 8 Odniesienia
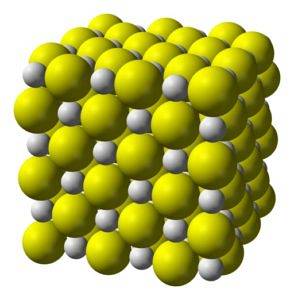
Struktura
Siarczek wapnia jest silnie jonowym związkiem utworzonym przez jon wapnia Cadwa+ i jon siarczkowy Sdwa-.
Krystalizuje do sześciennej struktury jak sól kamienna.
Nomenklatura
- Siarczek wapnia
Właściwości fizyczne
Stan fizyczny
Żółtawo-białe krystaliczne ciało stałe, sześcienne kryształy podobne do tych z chlorku sodu.
Waga molekularna
72,144 g / mol
Temperatura topnienia
2528 ºC
Gęstość
2,59 g / cm3
Rozpuszczalność
Rozpuszczalny w wodzie. Nierozpuszczalny w etanolu.
Właściwości chemiczne
Wodny roztwór
Gdy CaS rozpuszcza się w wodzie, rozdziela się na jony wapnia Ca. dwa+ i siarka S.dwa-. Ten ostatni w wodzie przyjmuje proton i staje się jonem wodorosiarczkowym SH- uwalnianie jonu hydroksylowego OH-.
Sdwa- + H.dwaO ⇔ SH- + O-
Dlatego roztwory siarczku wapnia CaS są alkaliczne (mają zasadowe pH) i nie zawierają jonów S.dwa- ale SH-.
Dopiero po dodaniu do roztworu dużej ilości alkaliów, takich jak wodorotlenek sodu NaOH, równowaga przesuwa się w kierunku tworzenia jonów siarczkowych Sdwa-.

SH- może wziąć kolejny proton H.+ z wody, tworząc siarkowodór, który jest bardzo toksycznym związkiem.
SH- + H.dwaO ⇔ HdwaS + OH-
Z tego powodu w wodzie tworzą się niewielkie ilości H.dwaTak, a CaS wystawiony na działanie wilgoci w środowisku wydziela nieprzyjemny zapach typowy dla siarkowodoru.
Związki obecne po rozpuszczeniu w wodzie
W wyniku reakcji w wodzie wskazanych powyżej powstaje Ca (SH)dwa, Ca (OH)dwa i Ca (SH) (OH).
CaS + HdwaO → Ca (SH) (OH)
Ca (SH) (OH) + HdwaO → Ca (OH)dwa + H.dwaS
Reakcja z kwasami
Te same reakcje, które zachodzą w wodzie, powodują reakcję CaS z kwasami tworzącymi HdwaS.
CaS + 2 HCl → CaCldwa + H.dwaS
Inne reakcje
Jeśli roztwór siarczku wapnia zostanie podgrzany siarką, otrzymuje się jony polisiarczkowe S.4dwa- i S.3dwa-.
Jeśli CaS jest ogrzewany w suchym powietrzu lub czystym tlenie, związek utlenia się do siarczynu wapnia CaSO3 a następnie do siarczanu wapnia CaSO4:
2 CaS + 3 Odwa → 2 CaSO3
2 CaSO3 + LUBdwa → 2 CaSO4
Zawiera środki utleniające, takie jak chloran potasu KClO3, azotan potasu KNO3 lub dwutlenek ołowiu PbOdwa pojawiają się gwałtowne reakcje.
Otrzymywanie
Siarczek wapnia można wytworzyć przez kalcynowanie (ogrzewanie do bardzo wysokiej temperatury) pierwiastków wapnia (Ca) i siarki (S) w atmosferze obojętnej, to znaczy, na przykład, bez tlenu lub pary wodnej..
Ca + S + ciepło → CaS
Można go również otrzymać przez ogrzewanie siarczanu wapnia CaSO4 z węglem drzewnym:
Walizka4 + 2 C → CaS + 2 COdwa
Jednak w tym drugim przypadku nie otrzymuje się czystego CaS, ponieważ reaguje on dodatkowo z CaSO4 tworząc CaO i SOdwa.
CaS jest również wytwarzany przez spalanie odpadów węglowych.
Obecność w przyrodzie
CaS występuje naturalnie w mineralnym oldhamicie. Jest to składnik niektórych meteorytów i jest ważny dla badań naukowych prowadzonych nad Układem Słonecznym..
Uważa się, że Oldhamite powstał w wyniku kondensacji w mgławicy, która zapoczątkowała Układ Słoneczny. Występuje również w wulkanach.

Ponadto siarczek wapnia jest wytwarzany naturalnie przez redukcję CaSO4 (tynk) prawdopodobnie z powodu działania bakterii.
Aplikacje
Ze świecących materiałów
Jednym z najbardziej rozpowszechnionych zastosowań siarczku wapnia jest baza dla związków luminescencyjnych. Są to substancje, które w pewnych okolicznościach emitują światło widzialne..
W luminescencyjnych związkach CaS działa jako baza, a do struktury dodawane są aktywatory, takie jak chlorki niektórych pierwiastków, takich jak cer (Ce3+) i europ (Eudwa+).
Materiał powstały w wyniku połączenia CaS i aktywatora jest używany np. W ekranach kineskopowych, które tworzą stare ekrany komputerów lub komputerów lub starych telewizorów.

Są również stosowane w obecnych lampach diodowych lub LED. Diody emitujące światło).

Materiały te są również wykorzystywane w świecących farbach i lakierach..
W medycynie
Siarczek wapnia został uznany w medycznych badaniach naukowych za lek stosowany w leczeniu wysokiego ciśnienia krwi (wysokiego ciśnienia w tętnicach). Jest to choroba dotykająca układ sercowo-naczyniowy wielu osób (serce i naczynia krwionośne).
CaS jest uważany za „dawcę” H.dwaS. Odgrywa ważną rolę w regulacji napięcia lub siły naczyń krwionośnych, więc podanie CaS może być możliwym lekarstwem na nadciśnienie.

W uzyskaniu innych związków
Siarczek wapnia umożliwia wytwarzanie innych związków, takich jak azotan wapnia Ca (NO3)dwa:
CaS + 2 HNO3 → Ca (NIE3)dwa + H.dwaS
Był również używany do otrzymywania węglanu wapnia CaCO3. W tym celu wodny roztwór CaS poddaje się karbonatyzacji za pomocą COdwa:
CaS + HdwaO + COdwa → H.dwaS + CaCO3
Inne aplikacje
Siarczek wapnia jest również stosowany jako dodatek smarny i jako środek flotacyjny w ekstrakcji minerałów..
Ryzyka
Siarczek wapnia może powodować podrażnienie skóry, oczu i dróg oddechowych. Należy obchodzić się z nim ostrożnie i przy użyciu odpowiedniego sprzętu ochronnego.
Jest to związek bardzo toksyczny dla organizmów wodnych, więc jest niebezpieczny dla tych środowisk.
Bibliografia
- Cotton, F. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Lide, D.R. (redaktor). (2005). Podręcznik chemii i fizyki CRC. 85th CRC Press.
- Ropp, R.C. (2013). Grupa 16 (O, S, Se, Te) związki ziem alkalicznych. Siarczek wapnia. W Encyclopedia of the Alkaline Earth Compounds. Odzyskany z sciencedirect.com.
- Li, Y.F. et al. (2009). Siarczek wapnia (CaS), donor siarkowodoru (H (2) S): nowy lek przeciwnadciśnieniowy? Med Hypotheses, 2009 wrzesień; 73 (3): 445–7. Odzyskany z ncbi.nlm.nih.gov.
- Dom J.E. and House, K.A. (2016). Siarka, selen i tellur. Występowanie siarki. In Descriptive Inorganic Chemistry (wydanie trzecie). Odzyskany z sciencedirect.com.
- NAS. National Library of Medicine. (2019). Siarczek wapnia. Odzyskany z pubchem.ncbi.nlm.nih.gov.
- De Beer, M. i in. (2014). Przemiana siarczku wapnia w węglan wapnia w procesie odzyskiwania siarki elementarnej z odpadów gipsowych. Zarządzanie odpadami, listopad 2014; 34 (11): 2373–81. Odzyskany z ncbi.nlm.nih.gov.



Jeszcze bez komentarzy