
Struktura siarczku miedzi, właściwości, zastosowania

Plik siarczek miedzi to rodzina związków nieorganicznych, których ogólny wzór chemiczny to CuxSY. tak x Jest większy niż Y oznacza to, że wspomniany siarczek jest bogatszy w miedź niż w siarkę; a jeśli wręcz przeciwnie, x Jest mniejszy niż Y, wtedy siarka jest bogatsza w siarkę niż miedź.
W przyrodzie przeważają liczne minerały, stanowiące naturalne źródła tego związku. Prawie wszystkie z nich są bogatsze w miedź niż w siarkę, a ich skład wyraża i upraszcza wzór CuxS; tutaj x może nawet przyjmować wartości ułamkowe, wskazujące na niestechiometryczne ciało stałe (Cu1,75S, na przykład).

Chociaż siarka jest w stanie elementarnym żółta, jej pochodne związki mają ciemny kolor; dotyczy to również siarczku miedzi. Jednak mineralny kowelit (górne zdjęcie), który składa się głównie z CuS, wykazuje metaliczny połysk i niebieskawą opalizację..
Można je wytwarzać z różnych źródeł miedzi i siarki, stosując różne techniki i zmieniając parametry syntezy. W ten sposób można uzyskać nanocząsteczki CuS o ciekawej morfologii.
Indeks artykułów
- 1 Struktura siarczku miedzi
- 1.1 Linki
- 1.2 Koordynacje w covelita
- 1.3 Inne kryształy
- 2 Właściwości
- 2.1 Ogólne
- 2.2 Covelite
- 3 Zastosowania
- 3.1 Nanocząsteczki w medycynie
- 3.2 Nanonauka
- 4 Odnośniki
Struktura siarczku miedzi
Spinki do mankietów
Związek ten ma wygląd krystaliczny, więc od razu można pomyśleć, że składa się z jonów Cu+ (miedź monowalentna), Cudwa+ (miedź dwuwartościowa), S.dwa- i, włącznie, S.dwa- i S.dwadwa- (aniony dwusiarczkowe), które oddziałują poprzez siły elektrostatyczne lub wiązania jonowe.
Istnieje jednak niewielki charakter kowalencyjny między Cu i S, dlatego nie można wykluczyć wiązania Cu-S. Z tego rozumowania krystaliczna struktura CuS (i wszystkich jego pochodnych ciał stałych) zaczyna się różnić od tych znalezionych lub scharakteryzowanych dla innych związków jonowych lub kowalencyjnych..
Innymi słowy, nie możemy mówić o czystych jonach, ale w środku ich przyciągania (kationowo-anionowy) zachodzi niewielkie nakładanie się ich zewnętrznych orbitali (współdzielenie elektronów).
Koordynacje w la covelita
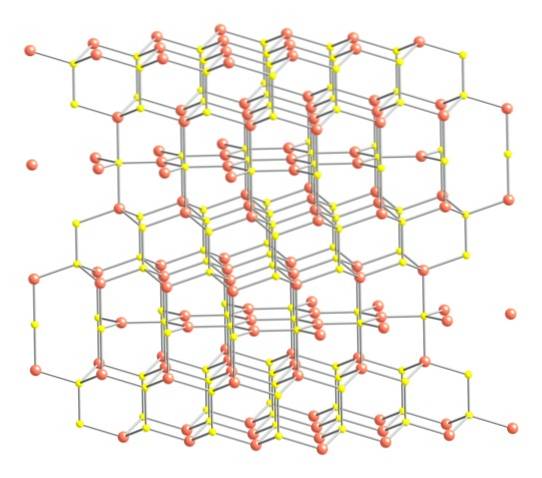
Mając powyższe na uwadze, na górnym obrazku pokazano strukturę krystaliczną kowelitu. Składa się z sześciokątnych kryształów (określonych przez parametry ich komórek elementarnych), w których jony łączą się i orientują w różnych koordynacjach; są to z różną liczbą bliskich sąsiadów.
Na obrazie jony miedzi są reprezentowane przez różowe kule, a jony siarki są reprezentowane przez żółte kule..
Skupiając uwagę najpierw na różowych kulach, można zauważyć, że niektóre otoczone są trzema żółtymi kulami (koordynacja płaszczyzny trygonalnej), a inne czterema (koordynacja czworościenna)..
Pierwszy rodzaj miedzi, trygonalny, można zidentyfikować w płaszczyznach prostopadłych do sześciokątnych ścian zwróconych w stronę czytnika, w których z kolei znajduje się drugi rodzaj węgla, czworościenny.
Przechodząc teraz do żółtych kul, niektóre mają pięć różowych kul jako sąsiadów (koordynacja trygonalna dwupiramidowa), a inne trzy i żółtą kulę (znowu koordynacja czworościenna); W tym ostatnim widać anion dwusiarczkowy, który można zobaczyć poniżej iw tej samej strukturze kowelitu:
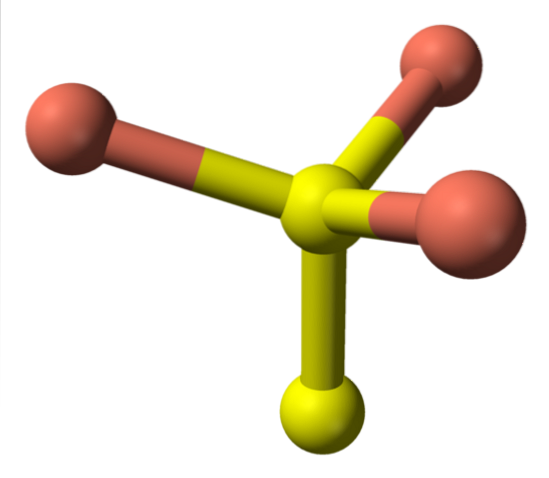
Alternatywna formuła
Są wtedy jony Cudwa+, Cu+, Sdwa- i S.dwadwa-. Jednak badania przeprowadzone za pomocą rentgenowskiej spektroskopii fotoelektronów (XPS) wskazują, że cała miedź jest kationami Cu+; i dlatego początkowy wzór CuS jest wyrażony jako „lepszy” jako (Cu+)3(S2−) (S.dwa)-.
Należy zauważyć, że stosunek Cu: S dla powyższego wzoru nadal wynosi 1, a ponadto opłaty się anulują.
Inne kryształy
Siarczek miedzi może przyjmować kryształy rombowe, jak w przypadku polimorfu γ-CudwaS, z chalkoocytu; sześcienny, jak w innym polimorfie chalkocytu, α-CudwaS; tetragonalny, w mineralnym anilicie, Cu1,75S; monokliniki, w djurleita, Cu1,96Tak, między innymi.
Każdy określony kryształ ma jeden minerał, a każdy z nich ma swoje własne cechy i właściwości.
Nieruchomości
Generał
Właściwości siarczku miedzi zależą od stosunku Cu: S jego ciał stałych. Na przykład te z anionami S.dwadwa- mają strukturę sześciokątną i mogą być półprzewodnikami lub metalowymi przewodnikami.
Jeśli z drugiej strony zawartość siarki składa się tylko z anionów Sdwa-, siarczki zachowują się jak półprzewodniki, a także wykazują przewodnictwo jonowe w wysokich temperaturach. Dzieje się tak, ponieważ jego jony zaczynają wibrować i poruszać się w kryształach, przenosząc w ten sposób ładunki elektryczne..
Optycznie, chociaż zależy to również od składu miedzi i siarki, siarczki mogą, ale nie muszą, absorbować promieniowanie w zakresie podczerwieni widma elektromagnetycznego. Te właściwości optyczne i elektryczne sprawiają, że są to potencjalne materiały do zastosowania w różnych zakresach urządzeń..
Inną zmienną, którą należy wziąć pod uwagę, oprócz stosunku Cu: S, jest rozmiar kryształów. Nie dość, że jest więcej siarczków miedzi „siarki” lub „miedzi”, to wymiary ich kryształów wpływają nieprecyzyjnie na ich właściwości; Dlatego naukowcy chętnie badają i poszukują zastosowań dla nanocząstek Cu.xSY.
Covelite
Każdy minerał lub siarczek miedzi ma unikalne właściwości. Jednak ze wszystkich najciekawszy jest kowelit pod względem strukturalnym i estetycznym (ze względu na opalizujący i niebieski ton). Dlatego poniżej wymieniono niektóre z jego właściwości.
Masa cząsteczkowa
95,611 g / mol.
Gęstość
4,76 g / ml.
Temperatura topnienia
500 ° C; ale się psuje.
Rozpuszczalność w wodzie
3,3 10-5 g / 100 ml w 18 ° C.
Aplikacje
Nanocząsteczki w medycynie
Nie tylko rozmiar cząstek zmienia się, aż osiągną wymiary nanometryczne, ale także ich morfologie mogą się znacznie różnić. Zatem siarczek miedzi może tworzyć nanosfery, pręty, płytki, cienkie warstwy, klatki, kable lub rurki..
Te cząstki i ich atrakcyjne morfologie mają indywidualne zastosowania w różnych dziedzinach medycyny..
Na przykład nanokomórki lub puste kule mogą służyć jako nośniki leków w organizmie. Zastosowano nanosfery, wspomagane elektrodami ze szkła węglowego i nanorurkami węglowymi, jako detektory glukozy; jak również jego agregaty są wrażliwe na wykrywanie biomolekuł, takich jak DNA.
Nanorurki CuS przewyższają nanosfery w wykrywaniu glukozy. Oprócz tych biomolekuł zaprojektowano immunosensory z cienkich warstw CuS i niektórych nośników do wykrywania patogenów..
Nanokryształy i amorficzne agregaty CuS mogą nawet powodować apoptozę komórek rakowych, nie uszkadzając zdrowych komórek.
Nanonauka
W poprzednim podrozdziale powiedziano, że jego nanocząsteczki są częścią biosensorów i elektrod. Oprócz takich zastosowań naukowcy i technicy wykorzystali również jego właściwości do projektowania ogniw słonecznych, kondensatorów, baterii litowych i katalizatorów do bardzo specyficznych reakcji organicznych; Niezbędne elementy nanonauki.
Warto również wspomnieć, że wsparty na węglu aktywnym zestaw NpCuS-CA (CA: Activated Carbon, and Np: Nanoparticles) okazał się być usuwaczem barwników szkodliwych dla człowieka, a tym samym oczyszcza źródła pochłanianie wody przez niepożądane cząsteczki.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Wikipedia. (2019). Siarczek miedzi. Odzyskane z: en.wikipedia.org
- Ivan Grozdanov i Metodija Najdoski. (1995). Właściwości optyczne i elektryczne warstw siarczku miedzi o zmiennym składzie. Journal of Solid State Chemistry, tom 114, wydanie 2, 1 lutego 1995, strony 469-475. doi.org/10.1006/jssc.1995.1070
- Narodowe Centrum Informacji Biotechnologicznej. (2019). Siarczek miedzi (CuS). Baza danych PubChem. CID = 14831. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Peter A. Ajibade i Nandipha L. Botha. (2017). Synteza, właściwości optyczne i strukturalne
- nanokryształów siarczku miedzi z prekursorów pojedynczych cząsteczek. Wydział Chemii, University of Fort Hare, Private Bag X1314, Alice 5700, Republika Południowej Afryki. Nanomateriały, 7, 32.
- Współpraca: Autorzy i redaktorzy tomów III / 17E-17F-41C (s.f.). Struktura krystaliczna siarczków miedzi (Cu2S, Cu (2-x) S), parametry sieci krystalicznej. W: Madelung O., Rössler U., Schulz M. (red.) Non-Tetrahedrally Bonded Elements and Binary Compounds I. Landolt-Börnstein-Group III Condensed Matter (Numerical Data and Functional Relationships in Science and Technology), tom 41C. Springer, Berlin, Heidelberg.
- Momtazan, F., Vafaei, A., Ghaedi, M. i in. Koreański J. Chem. Eng. (2018). Zastosowanie węgla aktywnego obciążonego nanocząsteczkami siarczku miedzi do jednoczesnej adsorpcji trójskładnikowych barwników: Metodologia powierzchni odpowiedzi. 35: 1108. doi.org/10.1007/s11814-018-0012-1
- Goel, S., Chen, F. i Cai, W. (2014). Synteza i biomedyczne zastosowania nanocząstek siarczku miedzi: od czujników do teranostyki. Mały (Weinheim an der Bergstrasse, Niemcy), 10 (4), 631-645. doi: 10.1002 / smll.201301174



Jeszcze bez komentarzy