
Układ okresowy historii pierwiastków, budowa, elementy

Plik układ okresowy pierwiastków to narzędzie, które pozwala zapoznać się z właściwościami chemicznymi 118 znanych do tej pory pierwiastków. Jest to niezbędne przy wykonywaniu obliczeń stechiometrycznych, przewidywaniu właściwości fizycznych pierwiastka, ich klasyfikowaniu i znajdowaniu właściwości okresowych wśród nich wszystkich..
Atomy stają się cięższe, ponieważ ich jądra dodają protony i neutrony, którym muszą towarzyszyć nowe elektrony; inaczej nie byłaby możliwa elektroobojętność. Tak więc niektóre atomy są bardzo lekkie, na przykład wodór, a inne, super ciężkie, na przykład oganeson.
Komu zawdzięcza się takie serce w chemii? Do naukowca Dmitrija Mendelejewa, który w 1869 roku (prawie 150 lat temu) opublikował po dekadzie teoretycznych studiów i eksperymentów pierwszy układ okresowy, próbując uporządkować 62 znane wówczas pierwiastki.
W tym celu Mendeleev oparł się na właściwościach chemicznych, a jednocześnie Lothar Meyer opublikował inny układ okresowy uporządkowany zgodnie z właściwościami fizycznymi pierwiastków..
Początkowo w tabeli znajdowały się „puste przestrzenie”, których elementy w tamtych latach nie były znane. Jednak Mendelejew był w stanie przewidzieć kilka jego właściwości ze znaczną dokładnością. Niektóre z tych pierwiastków to: german (który nazwał eka-krzem) i gal (eka-aluminium).
Pierwsze tablice okresowe uporządkowały pierwiastki według ich mas atomowych. To uporządkowanie ujawniło pewną okresowość (powtarzalność i podobieństwo) we właściwościach chemicznych pierwiastków; jednak elementy przejściowe nie zgadzały się z tą kolejnością, podobnie jak gazy szlachetne.
Z tego powodu konieczne było uporządkowanie pierwiastków ze względu na liczbę atomową (liczbę protonów), a nie masę atomową. Stąd, wraz z ciężką pracą i wkładem wielu autorów, układ okresowy Mendelejewa został udoskonalony i uzupełniony..
Indeks artykułów
- 1 Historia układu okresowego
- 1.1 Elementy
- 1.2 Symbolika
- 1.3 Ewolucja programu
- 1.4 Telluric śruba Chancourtois (1862)
- 1,5 Octaves of Newlands (1865)
- 1.6 Tabela Mendelejewa (1869)
- 1.7 Układ okresowy Moseleya (obecny układ okresowy) - 1913
- 2 Jak to jest zorganizowane? (Struktura i organizacja)
- 2.1 Okresy
- 2.2 Grupy
- 2.3 Liczby protonów a elektrony walencyjne
- 3 Elementy układu okresowego pierwiastków
- 3.1 Blok s
- Blok 3,2 p
- 3.3 Reprezentatywne elementy
- 3.4 Metale przejściowe
- 3.5 Wewnętrzne metale przejściowe
- 3.6 Metale i niemetale
- 3.7 Rodziny metali
- 3.8 Metaloidy
- 3.9 Gazy
- 4 Zastosowania i aplikacje
- 4.1 Przewidywanie wzorów tlenków
- 4.2 Wartości elementów
- 4.3 Cyfrowe układy okresowe
- 5 Znaczenie układu okresowego
- 6 Odnośniki
Historia układu okresowego
Elementy
Wykorzystywanie pierwiastków jako podstawy do opisu środowiska (a dokładniej przyrody) było stosowane od czasów starożytnych. Jednak wtedy określano je jako fazy i stany skupienia, a nie w taki sposób, w jaki od średniowiecza..
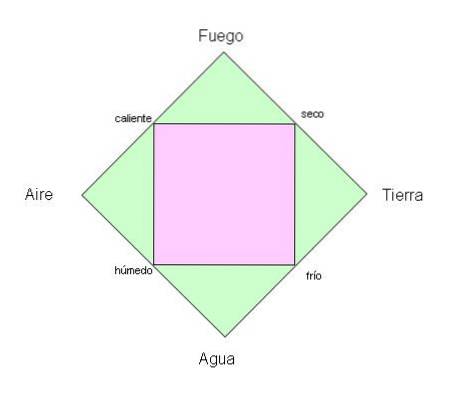
Starożytni Grecy wierzyli, że planeta, którą zamieszkujemy, składa się z czterech podstawowych elementów: ognia, ziemi, wody i powietrza..
Z drugiej strony w starożytnych Chinach liczba pierwiastków wynosiła pięć i, w przeciwieństwie do Greków, wykluczały one powietrze i zawierały metal i drewno..

Pierwszego naukowego odkrycia dokonał w 1669 roku niemiecki Henning Brand, który odkrył fosfor; na ten dzień wszystkie kolejne pozycje zostały zapisane.

Warto wyjaśnić, że niektóre pierwiastki, takie jak złoto i miedź, były znane już przed pojawieniem się fosforu; różnica polega na tym, że nigdy ich nie zarejestrowano.
Symbologia
Alchemicy (przodkowie dzisiejszych chemików) nadali elementom nazwy w odniesieniu do konstelacji, ich odkrywców i miejsc, w których zostały odkryte.
W 1808 roku Dalton zaproponował serię rysunków (symboli) reprezentujących elementy. Później ten system notacji został zastąpiony przez Jhona Berzeliusa (używanego do tej pory), ponieważ model Daltona stał się bardziej skomplikowany wraz z pojawieniem się nowych elementów..
Ewolucja schematu
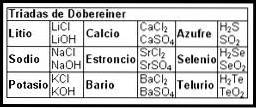
Pierwsze próby stworzenia mapy porządkującej informacje o pierwiastkach chemicznych miały miejsce w XIX wieku z triadami Döbereinera (1817).
Z biegiem lat odkryto nowe elementy, dające początek nowym modelom organizacyjnym, aż do obecnie stosowanego..
Chancourtois Telluric Screw (1862)
Alexandré-Émile Béguyer de Chancourtois zaprojektował papierową helisę przedstawiającą wykres spirali (śruba telluryczna).
W tym systemie pierwiastki są uporządkowane rosnąco w odniesieniu do ich mas atomowych. Podobne elementy są wyrównane w pionie.
Octaves of Newlands (1865)
Kontynuując prace Döbereinera, Brytyjczyk John Alexander Reina Newlands uporządkował pierwiastki chemiczne w rosnącej kolejności względem mas atomowych, zauważając, że co siedem pierwiastków miało podobieństwa we właściwościach (wodór nie jest wliczony).
Stół Mendelejewa (1869)
Mendelejew uporządkował pierwiastki chemiczne w kolejności rosnącej względem masy atomowej, umieszczając w tej samej kolumnie te, których właściwości były podobne. Pozostawił luki w swoim modelu układu okresowego, przewidując pojawienie się nowych pierwiastków w przyszłości (oprócz przewidywania właściwości, które powinien mieć).
Gazy szlachetne nie pojawiają się na stole Mendelejewa, ponieważ nie zostały jeszcze odkryte. Ponadto Mendeleiv nie rozważał wodoru.
Układ okresowy Moseleya (obecny układ okresowy) - 1913
Henry Gwyn Jeffreys Moseley zaproponował uporządkowanie pierwiastków chemicznych w układzie okresowym według ich liczby atomowej; to znaczy jako funkcja liczby protonów.
Moseley ogłosił „Prawo okresowe” w 1913 roku: „Kiedy pierwiastki są uporządkowane według numerów atomowych, ich właściwości fizyczne i chemiczne wykazują okresowe trendy”.
W ten sposób każdy poziomy wiersz lub okres przedstawia jeden typ relacji, a każda kolumna lub grupa - inny..
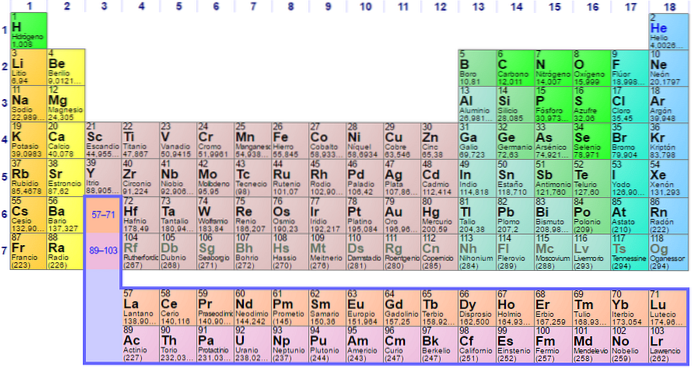
Jak to jest zorganizowane? (Struktura i organizacja)
Widać, że pastel układu okresowego ma kilka kolorów. Każdy kolor kojarzy pierwiastki o podobnych właściwościach chemicznych. Istnieją pomarańczowe, żółte, niebieskie, fioletowe kolumny; zielone kwadraty i przekątna zielonego jabłka.
Zwróć uwagę, że komórki w środkowych kolumnach są koloru szarego, więc wszystkie te elementy muszą mieć coś wspólnego, a mianowicie to, że są metalami przejściowymi z półpełnymi orbitaliami d..
W ten sam sposób elementy fioletowych kwadratów, chociaż przechodzą z substancji gazowych, od czerwonawej cieczy do stałej czarno-fioletowej (jod) i srebrnoszarej (astat), to ich właściwości chemiczne sprawiają, że są kongenerami. Te właściwości są regulowane przez struktury elektronowe jego atomów..
Organizacja i struktura układu okresowego nie jest dowolna, ale przestrzega szeregu okresowych właściwości i wzorów wartości określonych dla pierwiastków. Na przykład, jeśli metaliczny charakter zmniejsza się od lewej do prawej strony stołu, nie można oczekiwać metalowego elementu w prawym górnym rogu.
Okresy
Elementy są ułożone w rzędy lub okresy w zależności od poziomu energii ich orbitali. Przed okresem 4, kiedy pierwiastki następowały po sobie w rosnącej masie atomowej, stwierdzono, że dla każdych ośmiu z nich właściwości chemiczne powtarzały się (prawo oktaw Johna Newlandsa).
Metale przejściowe odlewano z innymi niemetalicznymi pierwiastkami, takimi jak siarka i fosfor. Z tego powodu wprowadzenie fizyki kwantowej i konfiguracji elektronów było kluczowe dla zrozumienia współczesnych układów okresowych..
Orbitale powłoki energetycznej zapełniają się elektronami (oraz jądrem protonów i neutronów), gdy porusza się ona przez okres. Ta warstwa energii idzie w parze z rozmiarem lub promieniem atomowym; dlatego elementy górnych okresów są mniejsze niż te poniżej.
H i On są na pierwszym (okresowym) poziomie energii; pierwszy rząd szarawych kwadratów w czwartym okresie; i rząd pomarańczowych kwadratów w szóstym okresie. Zauważ, że chociaż ten ostatni wydaje się być w rzekomym dziewiątym okresie, w rzeczywistości należy do szóstego, tuż po żółtym polu Ba.
Grupy
Przechodząc przez okres okazuje się, że wzrasta masa, liczba protonów i elektronów. W tej samej kolumnie lub grupie, chociaż masa i protony różnią się, liczba elektrony powłoki walencyjnej Jest taki sam.
Na przykład w pierwszej kolumnie lub grupie H ma pojedynczy elektron na orbicie 1s1, jak Li (2s1), sód (3s1), potas (4s1) i tak dalej, aż francium (7s1). Liczba 1 oznacza, że pierwiastki te prawie nie mają elektronu walencyjnego, a zatem należą do grupy 1 (IA). Każdy element występuje w różnych okresach.
Nie licząc wodoru w zielonej ramce, pierwiastki poniżej znajdują się w pomarańczowych ramkach i nazywane są metalami alkalicznymi. Jeszcze jedno pole po prawej stronie w dowolnym okresie to grupa lub kolumna 2; to znaczy, że jego elementy mają dwa elektrony walencyjne.
Ale gdy idziemy o krok dalej w prawo, bez znajomości orbitali d, dochodzi się do grupy boru (B) lub grupy 13 (IIIA); zamiast grupy 3 (IIIB) lub skandu (Sc). Biorąc pod uwagę wypełnienie orbitali d, zaczynamy przechodzić przez okresy szarawych kwadratów: metale przejściowe.
Liczby protonów a elektrony walencyjne
Podczas badania układu okresowego może powstać pomyłka między liczbą atomową Z lub całkowitą liczbą protonów w jądrze a liczbą elektronów walencyjnych. Na przykład węgiel ma Z = 6, to znaczy ma sześć protonów, a zatem sześć elektronów (w przeciwnym razie nie mógłby być atomem naładowanym obojętnie).
Ale z tych sześciu elektronów, cztery są z Walencji. Z tego powodu jego konfiguracja elektronowa to [He] 2sdwa2 Pdwa. [He] oznacza dwa elektrony 1sdwa warstwy zamkniętej i teoretycznie nie uczestniczą w tworzeniu wiązań chemicznych.
Ponadto, ponieważ węgiel ma cztery elektrony walencyjne, „dogodnie” znajduje się w grupie 14 (IVA) układu okresowego..
Pierwiastki poniżej węgla (Si, Ge, Sn, Pb i Fl) mają wyższe liczby atomowe (i masy atomowe); ale wszystkie mają wspólne cztery elektrony walencyjne. Jest to klucz do zrozumienia, dlaczego element należy do jednej grupy, a nie do innej..
Elementy układu okresowego
Bloki
Jak już wyjaśniono, grupy 1 i 2 charakteryzują się tym, że mają jeden lub dwa elektrony na s orbitali. Orbitale te mają geometrię sferyczną, a gdy ktoś schodzi przez którąkolwiek z tych grup, pierwiastki zyskują warstwy, które zwiększają rozmiar ich atomów..
Ponieważ wykazują silne tendencje w swoich właściwościach chemicznych i sposobach reagowania, pierwiastki te są zorganizowane jako blok s. Dlatego metale alkaliczne i metale ziem alkalicznych należą do tego bloku. Konfiguracja elektronowa elementów tego bloku to ns (1s, 2s itd.).
Chociaż pierwiastek hel znajduje się w prawym górnym rogu tabeli, jego konfiguracja elektronowa wynosi 1sdwa i dlatego należy do tego bloku.
Blok p
W przeciwieństwie do bloku s, elementy tego bloku całkowicie wypełniły orbitale s, podczas gdy ich orbitale p nadal są wypełnione elektronami. Konfiguracje elektroniczne elementów należących do tego bloku są typu nsdwanp1-6 (orbitale p mogą mieć jeden lub do sześciu elektronów do wypełnienia).
Więc gdzie w układzie okresowym znajduje się ten blok? Po prawej: zielone, fioletowe i niebieskie kwadraty; czyli pierwiastki niemetaliczne i metale ciężkie, takie jak bizmut (Bi) i ołów (Pb).
Począwszy od boru, z konfiguracją elektronową nsdwanp1, węgiel po jego prawej stronie dodaje kolejny elektron: 2sdwa2 Pdwa. Następnie konfiguracje elektronowe pozostałych elementów okresu 2 bloku p wynoszą: 2sdwa2 P3 (azot), 2sdwa2 P4 (tlen), 2sdwa2 P5 (fluor) i 2sdwa2 P6 (neon).
Jeśli zejdziesz do niższych okresów, będziesz miał poziom energii 3: 3sdwa3p1-6, i tak dalej, aż do końca bloku str.
Zauważ, że najważniejszą rzeczą w tym bloku jest to, że od okresu 4 jego elementy całkowicie wypełniały orbitale d (niebieskie pola po prawej). W skrócie: blok s znajduje się po lewej stronie układu okresowego, a blok p po prawej.
Reprezentatywne elementy
Jakie są reprezentatywne elementy? Są to takie, które z jednej strony łatwo tracą elektrony, az drugiej pozyskują je do uzupełnienia oktetu walencyjnego. Innymi słowy: są to elementy bloków si p.
Ich grupy różniły się od pozostałych literą A na końcu. Tak więc było osiem grup: od IA do VIIIA. Ale obecnie system numeracji stosowany w nowoczesnych układach okresowych to arabski, od 1 do 18, w tym metale przejściowe..
Z tego powodu grupa boru może być IIIA lub 13 (3 + 10); grupa węglowa, VAT lub 14; i gazów szlachetnych, ostatni po prawej stronie tabeli, VIIIA lub 18.
Metale przejściowe
Metale przejściowe to wszystkie elementy szarawych kwadratów. W ich okresach ich orbitale d są wypełnione, które są pięć i dlatego mogą mieć dziesięć elektronów. Ponieważ muszą mieć dziesięć elektronów, aby wypełnić te orbitale, musi być dziesięć grup lub kolumn.
Każda z tych grup w starym systemie numeracji została oznaczona cyframi rzymskimi i literą B na końcu. Pierwsza grupa, skandu, to IIIB (3), żelaza, kobaltu i niklu VIIIB o bardzo podobnych reaktywnościach (8, 9 i 10) oraz cynku IIB (12).
Jak widać, znacznie łatwiej jest rozpoznać grupy po liczbach arabskich niż za pomocą cyfr rzymskich..
Metale przejściowe wewnętrzne
Począwszy od okresu 6 układu okresowego, orbitale f stają się dostępne energetycznie. Muszą one być wypełnione najpierw niż orbitale d; dlatego też jego elementy są zwykle rozstawione, aby zbytnio nie wydłużać stołu.
Ostatnie dwa okresy, pomarańczowy i szary, to wewnętrzne metale przejściowe, zwane także lantanowcami (ziemami rzadkimi) i aktynowcami. Istnieje siedem orbitali f, które potrzebują czternastu elektronów do wypełnienia, a zatem musi być czternaście grup.
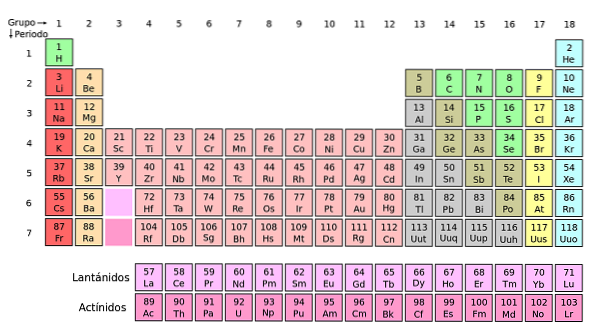
Jeśli te grupy zostaną dodane do układu okresowego, będzie ich łącznie 32 (18 + 14) i będzie „długa” wersja:
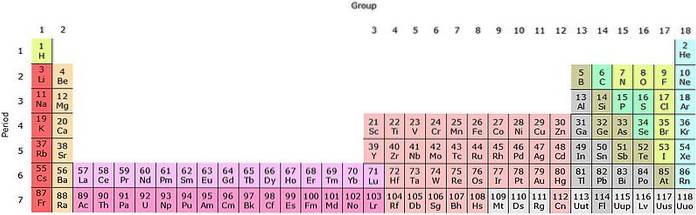
Jasnoróżowy rząd odnosi się do lantanowców, a ciemnoróżowy do aktynoidów. Lantan, La z Z = 57, aktyn, Ac z Z = 89 i cały blok f należą do tej samej grupy co skand. Dlaczego? Ponieważ skand ma drugi orbital1, który jest obecny w pozostałych lantanoidach i aktynoidach.
La i Ac mają ustawienia wartościowości 5d16sdwa i 6d17sdwa. Gdy przechodzisz w prawo przez oba rzędy, orbitale 4f i 5f zaczynają się wypełniać. Po napełnieniu dojdziesz do elementów lutetium, Lu i laurencio, Lr.
Metale i niemetale
Pozostawiając ciasto układu okresowego, wygodniej jest uciec się do tego na górnym obrazie, nawet w jego wydłużonej formie. W tej chwili zdecydowana większość wymienionych pierwiastków to metale.
W temperaturze pokojowej wszystkie metale są substancjami stałymi (z wyjątkiem rtęci, która jest ciekła) o srebrzysto-szarym kolorze (z wyjątkiem miedzi i złota). Ponadto wydają się być twarde i błyszczące; chociaż te z bloków są miękkie i kruche. Pierwiastki te charakteryzują się łatwością utraty elektronów i tworzenia kationów M.+.
W przypadku lantanowców tracą wszystkie trzy elektrony 5d16sdwa stać się trójwartościowymi kationami M3+ (jak ona3+). Z kolei cer jest zdolny do utraty czterech elektronów (Ce4+).
Z drugiej strony pierwiastki niemetalowe stanowią najmniejszą część układu okresowego. Są to gazy lub ciała stałe z kowalencyjnie połączonymi atomami (jak siarka i fosfor). Wszystkie znajdują się w bloku p; a dokładniej w jego górnej części, ponieważ zejście do dolnych okresów zwiększa metaliczny charakter (Bi, Pb, Po).
Ponadto niemetale zamiast tracić elektrony, zyskujesz je. W ten sposób tworzą aniony X- z różnymi ładunkami ujemnymi: -1 dla halogenów (grupa 17) i -2 dla chalkogenów (grupa 16, tlen).
Rodziny metaliczne
W przypadku metali istnieje wewnętrzna klasyfikacja, aby odróżnić je od siebie:
-Metale grupy 1 mają odczyn zasadowy
-Grupa 2, metale ziem alkalicznych (pan Becambara)
-Rodzina skandów z grupy 3 (IIIB). Ta rodzina składa się ze skandu, głowy grupy, itru Y, lantanu, aktynu i wszystkich lantanoidów i aktynoidów.
-Grupa 4 (IVB), rodzina tytanu: Ti, Zr (cyrkon), Hf (hafn) i Rf (rutherford). Ile mają elektronów walencyjnych? Odpowiedź jest w twojej grupie.
-Grupa 5 (VB), rodzina wanadu. Grupa 6 (VIB), rodzina chromu. I tak dalej, aż do rodziny cynku, grupa 12 (IIB).
Metaloidy
Metaliczny charakter rośnie od prawej do lewej i od góry do dołu. Ale jaka jest granica między tymi dwoma typami pierwiastków chemicznych? Ta granica składa się z pierwiastków zwanych metaloidami, które mają cechy zarówno metali, jak i niemetali..
Metaloidy można zobaczyć w układzie okresowym w „drabinie”, która zaczyna się od boru, a kończy na pierwiastku radioaktywnym astatynie. Te elementy to:
-B: bor
-Krzem: Tak
-Ge: german
-Jak: arszenik
-Sb: antymon
-Te: tellur
-At: astatine
Każdy z tych siedmiu pierwiastków wykazuje pośrednie właściwości, które różnią się w zależności od środowiska chemicznego lub temperatury. Jedną z tych właściwości jest półprzewodnik, to znaczy metaloidy są półprzewodnikami.
Gazy
W warunkach lądowych pierwiastki gazowe to metale nielekkie, takie jak azot, tlen i fluor. Do tej klasyfikacji należą również chlor, wodór i gazy szlachetne. Spośród nich najbardziej charakterystyczne są gazy szlachetne, ze względu na ich niską skłonność do reagowania i zachowywania się jak wolne atomy..
Te ostatnie znajdują się w grupie 18 układu okresowego i są to:
-Hel, On
-Neon, Ne
-Argon, Ar
-krypton, Kr
-Xenon, Xe
-Radon, Rn
-A najnowszy ze wszystkich, syntetyczny oganeson gazu szlachetnego, Og.
Wszystkie gazy szlachetne mają wspólną konfigurację walencyjną nsdwanp6; to znaczy mają pełny oktet walencyjny.
Stany skupienia pierwiastków w innych temperaturach
Pierwiastki są w stanie stałym, ciekłym lub gazowym w zależności od temperatury i siły ich oddziaływań. Gdyby temperatura Ziemi spadła do około zera absolutnego (0 K), wszystkie elementy zamarzłyby; z wyjątkiem helu, który by się kondensował.
W tej ekstremalnej temperaturze reszta gazów miałaby postać lodu.
Z drugiej strony, gdyby temperatura wynosiła około 6000 K, „wszystkie” elementy znajdowałyby się w stanie gazowym. W tych warunkach można było dosłownie zobaczyć chmury złota, srebra, ołowiu i innych metali.
Zastosowania i aplikacje
Sam układ okresowy zawsze był i będzie narzędziem konsultowania symboli, mas atomowych, struktur i innych właściwości pierwiastków. Jest niezwykle przydatny przy wykonywaniu obliczeń stechiometrycznych, które są na porządku dziennym w wielu zadaniach w laboratorium i poza nim.
Nie tylko to, ale także układ okresowy pozwala porównać elementy tej samej grupy lub okresu. W ten sposób można przewidzieć, jak będą wyglądały określone związki pierwiastków.
Przewidywanie wzorów tlenków
Na przykład w przypadku tlenków metali alkalicznych, ponieważ mają one pojedynczy elektron walencyjny, a zatem wartościowość +1, oczekuje się, że wzór ich tlenków będzie typu MdwaO. Sprawdza się to za pomocą tlenku wodoru, wody, HdwaO. Również z tlenkami sodu, NadwaO i potas, KdwaLUB.
W przypadku innych grup ich tlenki muszą mieć wzór ogólny MdwaLUBn, gdzie n jest równe numerowi grupy (jeśli element pochodzi z bloku p, obliczane jest n-10). Zatem węgiel, który należy do grupy 14, tworzy COdwa (DOdwaLUB4/dwa); siarka, z grupy 16, SO3 (SdwaLUB6/dwa); i azot, grupa 15, NdwaLUB5.
Nie dotyczy to jednak metali przejściowych. Dzieje się tak, ponieważ żelazo, choć należy do grupy 8, nie może stracić 8 elektronów, ale 2 lub 3. Dlatego zamiast zapamiętywać wzory, ważniejsze jest zwrócenie uwagi na wartościowości każdego pierwiastka..
Wartości elementów
Tabele okresowe (niektóre) pokazują możliwe wartościowości dla każdego elementu. Wiedząc to, nazewnictwo związku i jego wzór chemiczny można oszacować z góry. Walencje, jak wspomniano wcześniej, są związane z numerem grupy; chociaż nie dotyczy wszystkich grup.
Wartościowości zależą bardziej od struktury elektronowej atomów i od tego, które elektrony mogą faktycznie stracić lub zyskać..
Znając liczbę elektronów walencyjnych, możesz również zacząć od struktury Lewisa związku na podstawie tych informacji. Dlatego układ okresowy pozwala studentom i profesjonalistom szkicować struktury i ustąpić miejsca badaniom możliwych geometrii i struktur molekularnych..
Cyfrowe układy okresowe
Dzisiejsza technologia pozwoliła układom okresowym być bardziej wszechstronnymi i dostarczać więcej informacji dostępnych dla każdego. Kilka z nich zawiera uderzające ilustracje każdego elementu, a także krótkie podsumowanie jego głównych zastosowań.
Sposób, w jaki z nimi współpracujesz, przyspiesza zrozumienie i naukę. Układ okresowy powinien być przyjemnym dla oka narzędziem, łatwym do zbadania, a najskuteczniejszą metodą poznania jego pierwiastków chemicznych jest przechodzenie przez niego z okresów na grupy..
Znaczenie układu okresowego
Układ okresowy jest dziś najważniejszym narzędziem porządkującym w chemii ze względu na szczegółowe relacje jego pierwiastków. Jego zastosowanie jest niezbędne zarówno dla studentów i nauczycieli, jak i dla naukowców i wielu profesjonalistów zajmujących się dziedziną chemii i inżynierii..
Wystarczy spojrzeć na układ okresowy, aby szybko i skutecznie uzyskać ogromną ilość i informacje, takie jak:
- Lit (Li), beryl (Be) i bor (B) przewodzą prąd.
- Lit to metal alkaliczny, beryl to metal ziem alkalicznych, a bor to niemetal.
- Lit jest najlepszym przewodnikiem spośród trzech wymienionych, za nim plasuje się beryl i wreszcie bor (półprzewodnik).
W ten sposób, umieszczając te pierwiastki w układzie okresowym, można natychmiast stwierdzić ich tendencję do przewodnictwa elektrycznego..
Bibliografia
- Scerri, E. (2007). Układ okresowy: jego historia i znaczenie. Oxford New York: Oxford University Press.
- Scerri, E. (2011). Układ okresowy: bardzo krótkie wprowadzenie. Oxford New York: Oxford University Press.
- Moore, J. (2003). Chemia dla manekinów. Nowy Jork, NY: Wiley Pub.
- Venable, F.P… (1896). Rozwój prawa okresowego. Easton, Pensylwania: Chemical Publishing Company.
- Ball, P. (2002). Składniki: wycieczka z przewodnikiem po elementach. Oxford New York: Oxford University Press.
- Whitten, Davis, Peck & Stanley. Chemia. (8th ed.). CENGAGE Learning.
- Królewskie Towarzystwo Chemii. (2018). Układ okresowy. Odzyskany z: rsc.org
- Richard C. Banks. (Styczeń 2001). Tabela okresowa. Odzyskany z: chemistry.boisestate.edu
- Fizyka 2000. (patrz dalej). Pochodzenie układu okresowego. Odzyskany z: physics.bk.psu.edu
- King K. & Nazarewicz W. (7 czerwca 2018). Czy istnieje koniec układu okresowego? Odzyskany z: msutoday.msu.edu
- Dr Doug Stewart. (2018). Tabela okresowa. Źródło: chemicool.com
- Mendez A. (16 kwietnia 2010). Układ okresowy Mendelejewa. Odzyskany z: quimica.laguia2000.com


Jeszcze bez komentarzy