
Tenekteplaza do czego służy, budowa, mechanizm działania, dawka
Plik tenekteplaza to tkankowy aktywator plazminogenu (tPA) syntetyzowany przez przemysł farmaceutyczny przy użyciu technik rekombinacji DNA zastosowany do linii komórkowej otrzymanej z komórek jajnika chomika chińskiego.
Proces krzepnięcia krwi, który kończy się utworzeniem skrzepliny i wycofaniem skrzepu, jest kontynuowany w fazie zwanej fibrynolizą. Faza ta charakteryzuje się rozpuszczaniem skrzepliny poprzez fragmentację polimeru fibryny na mniejsze i bardziej rozpuszczalne peptydy oraz rekanalizację naczynia lub naczyń, w których nastąpiła koagulacja..
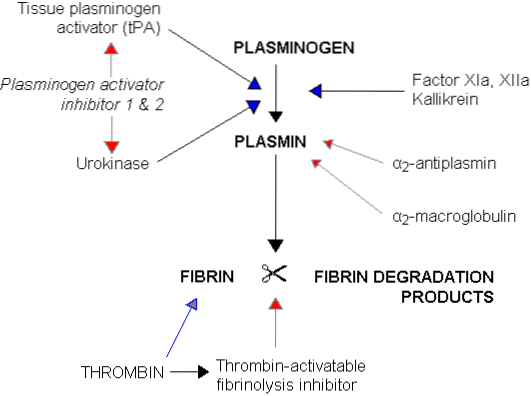
Ten proces fibrynolityczny wymaga udziału białka krwi z grupy globulin osocza zwanych plazminogenem lub profibrynolizyną o masie około 81 kDa, syntetyzowanych w wątrobie i normalnie obecnych we krwi krążącej. Ten plazminogen jest uwięziony podczas koagulacji między sieciami fibryny tworzącymi skrzeplinę..
Plasminogen jako taki nie ma żadnego działania fibrynolitycznego, działania, które pojawia się tylko wtedy, gdy oryginalna cząsteczka jest aktywowana i przekształcona w plazminę lub fibrynolizynę, która jest proteazą serynową bardzo podobną do trypsyny, która jest najważniejszym proteolitycznym enzymem trawiennym w wydzielaniu trzustki.
Plazmina ma duże powinowactwo do fibryny, którą rozkłada na małe rozpuszczalne peptydy, które z kolei hamują działanie trombiny i późniejszą produkcję większej ilości fibryny. Wywiera również działanie proteolityczne na fibrynogen, protrombinę i czynniki krzepnięcia V, VIII, IX, XI i XII, co również zmniejsza zdolność krzepnięcia krwi.
Z tabeli tej można wywnioskować, że plazmina wpływa na procesy krzepnięcia krwi w dwojaki sposób, ponieważ z jednej strony powoduje rozpuszczanie skrzepliny poprzez działanie fibrynolityczne, az drugiej strony zakłóca krzepnięcie poprzez działanie proteolityczne. czynniki procesu krzepnięcia.
Indeks artykułów
- 1 Do czego służy tenekteplaza?
- 2 Struktura cząsteczki
- 3 Mechanizm działania
- 4 Prezentacja
- 5 Dawka
- 6 Odnośniki
Do czego służy tenekteplaza?
Aktywacja plazminogenu następuje w wyniku indywidualnego lub połączonego działania zestawu substancji, które ogólnie nazywane są aktywatorami plazminogenu i które, zgodnie z ich pochodzeniem, są podzielone na aktywatory plazminogenu: krew, mocz, tkanki i mikroorganizmy.
Będąc aktywatorem plazminogenu tkankowego, który przekształca ją w plazminę, a plazmina jest par excellence środkiem fibrynolitycznym, ponieważ tenekteplaza jest stosowana do terapeutycznej fibrynolizy w ostrym zawale mięśnia sercowego, udarach zakrzepowo-zatorowych i zatorowości płucnej..
Struktura cząsteczki
Tenekteplaza jest glikoproteiną, która ma 527 aminokwasów w swojej pierwotnej strukturze, w której rozróżnia się dwie podstawowe domeny, jedną nazywaną domeną kringle, a drugą odpowiadającą domenie proteazy.
Domena kringle to obszar białka, który składa się w duże pętle, które są stabilizowane przez wiązania dwusiarczkowe. Ten typ domeny jest bardzo ważny, ponieważ umożliwia interakcje białko-białko, które zachodzą z czynnikami krzepnięcia krwi, a swoją nazwę zawdzięcza skandynawskiemu tortowi, którego kształt przypomina..
Domena proteazy to obszar cząsteczki, który ma aktywność proteolityczną, która sama nadaje enzymowi funkcję aktywującą..
Struktura cząsteczki jest bardzo podobna do struktury naturalnego ludzkiego tPA, jednak technologia rekombinacji DNA pozwoliła na wprowadzenie pewnych modyfikacji w jej komplementarnym DNA (cDNA), które nadały zakodowanemu w nim białku pewne korzyści terapeutyczne.
Wspomniane modyfikacje obejmują zastąpienie treoniny w pozycji 103 asparaginą i asparaginy 117 glutaminą, zmiany, które są zlokalizowane w domenie kringle; podczas gdy w domenie proteazy uzyskano montaż tetraalaniny w zakresie pozycji 296-299.
Mechanizm akcji
Mechanizm działania tenekteplazy jest podobny do naturalnego tPA. Po utworzeniu się skrzepliny plazminogen w swojej nieaktywnej postaci wiąże się z fibryną bez wywierania na nią żadnego działania proteolitycznego..
TPA wytwarzany przez komórki śródbłonka wiąże się z fibryną, nabywając w ten sposób swoje właściwości aktywujące plazminogen w plazminie, substancji, która wyzwala fibrynolizę.
Modyfikacje wytworzone w cząsteczce tPA i wprowadzone do tenekteplazy powodują, że aktywujące działanie tej substancji na plazminogen jest bardziej wrażliwe na obecność fibryny. Specyficzność fibryny, która ogranicza jej działanie do miejsc skrzepów i zmniejsza ogólnoustrojową aktywację plazminogenu i wynikającą z niej degradację fibrynogenu w osoczu.
Prezentacja
Dawkowanie lub siłę działania substancji wyraża się w mg i jednostkach (U) tenekteplazy. Jednostki stanowią specyficzny wzorzec odniesienia dla leku i nie są porównywalne z jednostkami innych leków trombolitycznych. Jeden mg to 200 jednostek (U).
Jedną z form biznesowych jest Metalyse, który jest dostępny w dwóch opakowaniach, z których każda zawiera fiolkę z produktem w postaci białego proszku i ampułko-strzykawkę z rozpuszczalnikiem, przezroczysty i bezbarwny, do rekonstytucji.
W jednym z nich fiolka zawiera 8000 jednostek (40 mg), a strzykawka 8 ml rozpuszczalnika. W drugiej fiolka zawiera 10 000 j. (50 mg), a strzykawka 10 ml. W obu przypadkach po rekonstytucji roztworu poprzez dodanie zawartości strzykawki do odpowiedniej fiolki, będzie on zawierał 1000 jednostek (5 mg) na każdy ml i będzie przezroczysty, bezbarwny lub lekko żółty..
Dawka
Leczenie tenekteplazą należy rozpocząć jak najszybciej, w ciągu 6 godzin od wystąpienia objawów. Ze względu na ukryte ryzyko krwawienia lub krwotoku powinien być przepisywany przez lekarzy z doświadczeniem w leczeniu trombolitycznym oraz w placówkach dysponujących środkami do monitorowania i przeciwdziałania tego typu działaniom niepożądanym..

Dawkowanie substancji powinno być oparte na masie ciała, przy minimalnej dawce 6000 jednostek, co odpowiada 30 mg rozpuszczonego w objętości 6 ml odtworzonego roztworu, do podawania pacjentom o masie ciała poniżej 60 kg..
Maksymalna dawka to 10 000 j. (50 mg / 10 ml roztworu) zarezerwowana dla pacjentów o masie ciała 90 kg i więcej..
Schemat dawkowania dla pacjentów o masie ciała od 60 do 90 kg jest następujący:
- ≥ 60 a < 70 = 7000 U (35 mg/7 ml)
- ≥ 70 a < 80 = 8000 U (40 mg/8 ml)
- ≥ 80 a < 90 = 9000 U (45 mg/9 ml)
Wymaganą dawkę należy podawać w pojedynczym dożylnym bolusie przez około 10 sekund. Można go podawać przez uprzednio podłączony obwód dożylny, przez który przepuszczany jest fizjologiczny roztwór chlorku sodu 0,9% (9 mg / ml).
Lek jest niezgodny z roztworami glukozy i chociaż zgodnie z aktualnymi kryteriami terapeutycznymi należy równolegle stosować uzupełniające leczenie przeciwzakrzepowe, które może obejmować leki przeciwpłytkowe i przeciwzakrzepowe, do roztworu tenekteplazy do wstrzykiwań nie należy dodawać żadnego innego leku..
Bibliografia
- Balsera, E. C., Palomino, M. Á. P., Ordoñez, J. M., Caler, C. L., Paredes, T. G. i García, G. Q. (2011). Skuteczność i bezpieczeństwo alteplazy i tenekteplazy w fibrynolizie ostrego zespołu wieńcowego z uniesieniem odcinka ST. Cardiocore, 46(4), 150-154.
- Bauer C i Walzog B: Blut: ein Flüssiges Organsystem, w: Fizjologia, 6th ed; R Klinke i in. (Red.). Stuttgart, Georg Thieme Verlag, 2010.
- Fatovich, D. M., Dobb, G. J., & Clugston, R. A. (2004). Pilotażowe badanie z randomizacją dotyczące trombolizy w zatrzymaniu krążenia (badanie TICA). Reanimacja, 61(3), 309-313.
- Guyton AC, Hall JE: Hemostasis and Blood Coagulation, w: Podręcznik fizjologii medycznej , 13 edycja, AC Guyton, JE Hall (red.). Filadelfia, Elsevier Inc., 2016.
- Haley Jr, E. C., Lyden, P. D., Johnston, K. C., Hemmen, T. M., & TNK in Stroke Investigators. (2005). Pilotażowe badanie bezpieczeństwa z eskalacją dawki tenekteplazy w ostrym udarze niedokrwiennym. Udar mózgu, 36(3), 607-612.
- Jelkman W: Blut, w: Physiologie des Menschen mit Pathophysiologie, 31 wyd., RF Schmidt i wsp. (Red.). Heidelberg, Springer Medizin Verlag, 2010.



Jeszcze bez komentarzy