
Historia bromu, budowa, konfiguracja elektronów, właściwości, zastosowania
Plik brom Jest to pierwiastek niemetaliczny należący do grupy halogenów grupy 17 (VIIA) układu okresowego. Jej symbol chemiczny to Br. Występuje jako dwuatomowa cząsteczka, której atomy są połączone wiązaniem kowalencyjnym, dla którego przypisano jej wzór cząsteczkowy Brdwa.
W przeciwieństwie do fluoru i chloru, brom w warunkach lądowych nie jest gazem, ale czerwono-brązową cieczą (zdjęcie poniżej). Dymi i wraz z rtęcią są jedynymi płynnymi pierwiastkami. Pod nim jod, mimo że intensyfikuje swój kolor i zmienia kolor na fioletowy, może krystalizować w lotną substancję stałą.

Brom został odkryty niezależnie w 1825 r. Przez Carla Löwiga, który studiował pod kierunkiem niemieckiego chemika Leopolda Gmelina; aw 1826 roku przez francuskiego chemika Antoine-Jérome Balard. Jednak publikacja wyników eksperymentalnych Balarda poprzedzała publikację Löwiga..
Brom jest 62. najbardziej rozpowszechnionym pierwiastkiem na Ziemi, występującym w niskich stężeniach w całej skorupie ziemskiej. W morzu średnie stężenie wynosi 65 ppm. Ciało ludzkie zawiera 0,0004% bromu, a jego funkcja nie jest ostatecznie znana..
Pierwiastek ten jest eksploatowany komercyjnie w solankach lub miejscach, które ze względu na szczególne warunki są miejscami o dużym stężeniu soli; na przykład Morze Martwe, do którego zbiegają się wody sąsiednich terytoriów, nasycone solami.
Jest to pierwiastek korozyjny zdolny do atakowania metali, takich jak platyna i pallad. Rozpuszczony w wodzie brom może również wywierać działanie korozyjne na tkanki ludzkie, pogarszając sytuację, ponieważ może wytwarzać się kwas bromowodorowy. Ze względu na swoją toksyczność może powodować znaczne uszkodzenia narządów, takich jak wątroba, nerki, płuca i żołądek.
Brom jest bardzo szkodliwy dla atmosfery, będąc 40-100 razy bardziej niszczący dla warstwy ozonowej niż chlor. Połowa strat warstwy ozonowej na Antarktydzie powstaje w wyniku reakcji związanych z bromometylem, związkiem stosowanym jako fumigant.
Ma wiele zastosowań, m.in .: uniepalniacz, wybielacz, środek do dezynfekcji powierzchni, dodatek do paliw, półprodukt do produkcji środków uspokajających, do produkcji chemii organicznej itp..
Indeks artykułów
- 1 Historia
- 1.1 Praca Carla Löwiga
- 1.2 Praca Antoine'a Balarda
- 2 Struktura i konfiguracja elektronowa bromu
- 2.1 Cząsteczka
- 2.2 Kryształy
- 2.3 Warstwa walencyjna i stany utlenienia
- 3 Właściwości
- 3.1 Wygląd fizyczny
- 3.2 Masa atomowa
- 3.3 liczba atomowa
- 3.4 Zapach
- 3.5 Temperatura topnienia
- 3.6 Temperatura wrzenia
- 3.7 Ciecz o gęstości (Br2)
- 3.8 Rozpuszczalność w wodzie
- 3.9 Rozpuszczalności
- 3.10 Punkt potrójny
- 3.11 Punkt krytyczny
- 3.12 Ciepło topnienia (Br2)
- 3.13 Ciepło parowania (Br2)
- 3.14 Molowa pojemność cieplna (Br2)
- 3.15 Prężność par
- 3.16 Temperatura samozapłonu
- 3.17 Temperatura zapłonu
- 3.18 Temperatura przechowywania
- 3.19 Napięcie powierzchniowe
- 3.20 Próg zapachu
- 3.21 Współczynnik załamania światła (ηD)
- 3.22 Elektroujemność
- 3.23 Energia jonizacji
- 3.24 Promień atomowy
- 3.25 Promień kowalencyjny
- 3.26 Promień Van der Waalsa
- 3.27 Reaktywność
- 4 Zastosowania
- 4.1 Dodatek do benzyny
- 4.2 Pestycydy
- 4.3 Kontrola emisji rtęci
- 4.4 Fotografia
- 4.5 Działania terapeutyczne
- 4.6 Ognioodporne
- 4.7 Dodatek do żywności
- 4.8 Odczynniki i półprodukt chemiczny
- 4.9 Działanie biologiczne
- 5 Gdzie znaleźć
- 6 Ryzyka
- 7 Referencje
Fabuła
Praca Carla Löwiga
Brom został odkryty niezależnie i prawie jednocześnie przez niemieckiego chemika Carla Jacoba Löwiga w 1825 roku i przez Antoine'a Balarda, francuskiego chemika w 1826 roku..
Carl Löwig, uczeń niemieckiego chemika Leopolda Gmelina, zebrał wodę ze źródła w Bad Kreuznach i dodał do niej chlor; po dodaniu eteru ciekłą mieszaninę mieszano.
Następnie eter oddestylowano i zatężono przez odparowanie. W rezultacie uzyskał czerwono-brązową substancję, którą był brom.
Praca Antoine'a Balarda
Balard ze swojej strony użył popiołu z brunatnic zwanych morszczynem i zmieszał je z solanką wydobytą z solnisk Montpellier. W ten sposób uwolnił brom, powodując przejście chloru przez wodny materiał poddany ekstrakcji, w którym obecny był bromek magnezu, MgBr.dwa.
Następnie materiał poddano destylacji w obecności dwutlenku manganu i kwasu siarkowego, w wyniku czego powstały czerwone opary, które skondensowały się w ciemną ciecz. Balard uważał, że to nowy element i nazwał go muride, wywodzącym się od łacińskiego słowa muria, którym oznaczono solankę.
Zauważono, że Balard zmienił nazwę z muride na brôme za sugestią Anglady lub Gay-Lussaca, opierając się na fakcie, że brôme oznacza wstrętny, co określa zapach odkrytego pierwiastka..
Wyniki zostały opublikowane przez Belarda w Annales of Chemie and Physique, zanim Löwig opublikował swoje.
Dopiero od 1858 r. Można było produkować brom w znacznych ilościach; roku odkryto i eksploatowano złoża soli w Stassfurcie, uzyskując brom jako produkt uboczny potażu.
Struktura i konfiguracja elektronowa bromu
Cząsteczka

Górny obraz przedstawia cząsteczkę bromu, Brdwa, z kompaktowym modelem wypełnienia. W rzeczywistości istnieje proste wiązanie kowalencyjne między dwoma atomami bromu, Br-Br.
Będąc jednorodną i dwuatomową cząsteczką, brakuje jej trwałego momentu dipolowego i może oddziaływać z innymi tego samego typu tylko za pomocą sił dyspersyjnych Londynu..
To jest powód, dla którego jego czerwonawa ciecz dymiąca; w cząsteczkach Brdwa, chociaż stosunkowo ciężkie, ich międzycząsteczkowe siły trzymają je luźno razem.
Brom jest mniej elektroujemny niż chlor i dlatego ma mniej atrakcyjny wpływ na elektrony w powłokach walencyjnych. W rezultacie wymaga mniej energii, aby podróżować na wyższych poziomach energii, pochłaniając zielone fotony i odbijając czerwonawy kolor..
Kryształy
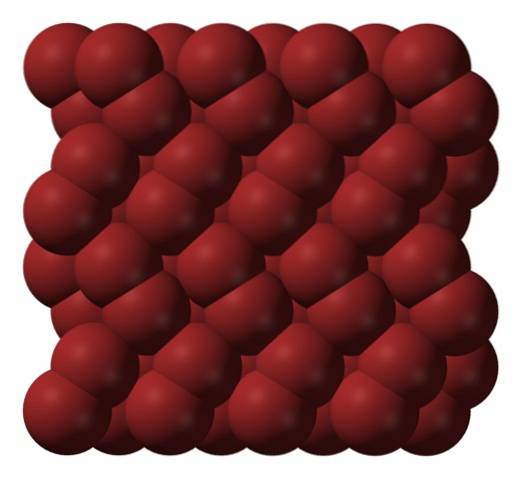
W fazie gazowej cząsteczki Brdwa rozdzielają się znacznie, aż nie ma między nimi efektywnych interakcji. Jednak poniżej temperatury topnienia brom może zamarznąć w czerwonawe kryształy rombowe (górne zdjęcie).
Zwróć uwagę, jak cząsteczki Brdwa są ułożone starannie w taki sposób, że wyglądają jak „robaki bromowe”. Tutaj i przy tych temperaturach (T. < -7,2°C), las fuerzas de dispersión son suficientes para que las vibraciones de las moléculas no desmoronen el cristal en el acto; pero aún así, varias de ellas sublimarán constantemente.
Warstwa walencyjna i stany utlenienia
Konfiguracja elektronowa bromu to:
[Ar] 3d104sdwa 4p5
Bycie 3d104sdwa 4p5 jego powłoka walencyjna (chociaż orbital 3d10 nie odgrywają wiodącej roli w swoich reakcjach chemicznych). Elektrony w orbitali 4s i 4p są najbardziej zewnętrznymi i sumują się do łącznie 7, tylko jeden elektron z ukończenia oktetu walencyjnego.
Z tej konfiguracji można wywnioskować możliwe stany utlenienia dla bromu: -1, jeśli zyskuje on elektron, który jest izoelektroniczny względem kryptonu; +1, pozostając jako 3d104sdwa 4p4; +3, +4 i +5, tracąc wszystkie elektrony z orbity 4p ([Ar] 3d104sdwa4p0); i +7, nie pozostawiając żadnych elektronów na orbicie 4s ([Ar] 3d104s04p0).
Nieruchomości
Wygląd fizyczny
Ciemnoczerwono-brązowa dymiąca ciecz. Występuje w naturze jako dwuatomowa cząsteczka, której atomy są połączone wiązaniem kowalencyjnym. Brom jest cieczą gęstszą od wody i tonie w niej.
Masa atomowa
79,904 g / mol.
Liczba atomowa
35.
Zapach
Ostry, duszący i drażniący dym.
Temperatura topnienia
-7,2 ° C.
Temperatura wrzenia
58,8 ºC.
Gęstość (Brdwa) ciekły
3,1028 g / cm3
Rozpuszczalność w wodzie
33,6 g / l przy 25 ° C Rozpuszczalność bromu w wodzie jest niska i ma tendencję do zwiększania się wraz ze spadkiem temperatury; zachowanie podobne do innych gazów.
Rozpuszczalności
Dobrze rozpuszczalny w alkoholu, eterze, chloroformie, czterochlorku węgla, disiarczku węgla i stężonym kwasie solnym. Rozpuszczalny w niepolarnych i niektórych polarnych rozpuszczalnikach, takich jak alkohol, kwas siarkowy i wiele rozpuszczalników chlorowcowanych.
Potrójny punkt
265,9 K do 5,8 kPa.
Punkt krytyczny
588 K przy 10,34 MPa.
Ciepło topnienia (Brdwa)
10571 kJ / mol.
Ciepło parowania (Brdwa)
29,96 kJ / mol.
Molowa pojemność cieplna (Brdwa)
75,69 kJ / mol.
Ciśnienie pary
W temperaturze 270 K, 10 kPa.
Temperatura samozapłonu
Niepalny.
punkt zapłonu
113 ºC.
Temperatura przechowywania
2 do 8 ºC.
Napięcie powierzchniowe
40,9 mN / m przy 25 ºC.
Próg zapachu
0,05-3,5 ppm. 0,39 mg / m23
Współczynnik załamania (ηD)
1,6083 przy 20 ºC i 1,6478 przy 25 ºC.
Elektroujemność
2,96 w skali Paulinga.
Energia jonizacji
- Poziom pierwszy: 1139,9 kJ / mol.
- Drugi poziom: 2103 kJ / mol.
- Trzeci poziom: 3470 kJ / mol.
Radio atomowe
120 po południu.
Promień kowalencyjny
120.3 po południu.
Radio Van der Waals
185 po południu.
Reaktywność
Jest mniej reaktywny niż chlor, ale bardziej reaktywny niż jod. Jest utleniaczem słabszym niż chlor i silniejszym niż jod. Jest również słabszym środkiem redukującym niż jod, ale silniejszym niż chlor..
Opary chloru są silnie żrące dla wielu materiałów i tkanek ludzkich. Działa niszcząco na wiele pierwiastków metalicznych, w tym platynę i pallad; ale nie atakuje ołowiu, niklu, magnezu, żelaza, cynku, a poniżej 300 ° C ani sodu.
Brom w wodzie ulega przemianie i zamienia się w bromek. Może również istnieć jako bromian (BrO3-), w zależności od pH cieczy.
Ze względu na swoje działanie utleniające, brom może wywoływać uwalnianie wolnych rodników tlenowych. Są to silne utleniacze i mogą powodować uszkodzenie tkanek. Ponadto brom może spontanicznie zapalić się w połączeniu z potasem, fosforem lub cyną..
Aplikacje
Dodatek do benzyny
Do usunięcia potencjalnych osadów ołowiu z silników samochodowych zastosowano dibromek etylenu. Po spaleniu benzyny, w której zastosowano ołów jako dodatek, brom w połączeniu z ołowiem tworzy bromek ołowiu, lotny gaz wydalany rurą wydechową..
Chociaż brom usuwał ołów z benzyny, jego niszczące działanie na warstwę ozonową było bardzo silne, dlatego został odrzucony do tego zastosowania..
Pestycydy
Bromek metylenu lub bromometylu był stosowany jako pestycyd do oczyszczania gleby, zwłaszcza w celu wyeliminowania pasożytniczych nicieni, takich jak tęgoryjce..
Jednak użycie większości związków zawierających brom zostało odrzucone ze względu na ich niszczące działanie na warstwę ozonową..
Kontrola emisji rtęci
W niektórych instalacjach brom jest stosowany w celu zmniejszenia emisji rtęci, bardzo toksycznego metalu..
Fotografia
Bromek srebra, oprócz jodku srebra i chlorku srebra, jest stosowany jako związek światłoczuły w emulsjach fotograficznych.
Działania terapeutyczne
Bromek potasu, a także bromek litu, były stosowane jako ogólne środki uspokajające w XIX i na początku XX wieku. W niektórych krajach nadal stosuje się bromki w postaci prostych soli jako leki przeciwdrgawkowe.
Jednak amerykańska FDA nie zatwierdza obecnie stosowania bromu w leczeniu jakiejkolwiek choroby..
Ognioodporny
Brom jest przekształcany przez płomienie w kwas bromowodorowy, który zakłóca reakcję utleniania zachodzącą podczas pożaru i powoduje jego gaszenie. Polimery zawierające brom są używane do produkcji żywic ognioodpornych.
Dodatek do żywności
Do mąki dodano śladowe ilości bromianu potasu, aby poprawić gotowanie.
Odczynniki i półprodukt chemiczny
Bromowodór jest stosowany jako środek redukujący i katalizator reakcji organicznych. Brom jest stosowany jako półprodukt chemiczny w produkcji leków, płynów hydraulicznych, środków chłodzących, osuszaczy oraz w preparatach do kręcenia włosów.
Znajduje również zastosowanie w produkcji płuczek wiertniczych, produktów do dezynfekcji wody, wybielaczy, środków do dezynfekcji powierzchni, barwników, dodatków do paliw itp..
Działanie biologiczne
Badania przeprowadzone w 2014 roku wskazują, że brom jest niezbędnym kofaktorem do biosyntezy kolagenu IV, co sprawia, że brom jest niezbędnym pierwiastkiem do rozwoju tkanek zwierzęcych. Brakuje jednak informacji o konsekwencjach deficytu pierwiastka.
Gdzie to się znajduje
Brom jest komercyjnie wydobywany z kopalni soli i głębokich dołów solankowych znajdujących się w stanie Arkansas oraz w Wielkim Jeziorze Słonym w stanie Utah w Stanach Zjednoczonych. Ta ostatnia solanka ma stężenie bromu 0,5%.
Aby wyekstrahować brom, do solanki dodaje się gorący gazowy chlor w celu utlenienia jonów bromkowych w roztworze, zbierając brom pierwiastkowy..
Morze Martwe, na granicy Jordanii i Izraela, jest morzem zamkniętym, które znajduje się poniżej poziomu morza, co powoduje, że ma bardzo wysokie stężenie soli.
Brom i potaż są tam pozyskiwane komercyjnie poprzez odparowywanie wysokosolnej wody z Morza Martwego. W tym morzu stężenie bromu może sięgać 5 g / l.
Występuje również w dużych stężeniach w niektórych gorących źródłach. Na przykład brominit jest minerałem będącym bromkiem srebra występującym w Boliwii i Meksyku..
Ryzyka
Brom w stanie ciekłym działa żrąco na tkanki ludzkie. Jednak największym zagrożeniem dla człowieka są opary bromu i ich wdychanie..
Oddychanie w środowisku o stężeniu bromu 11-23 mg / m3 wytwarza silne wstrząsy. Stężenie 30-60 mg / m3 to jest niezwykle szkodliwe. Tymczasem stężenie 200 mg może być śmiertelne.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Narodowe Centrum Informacji Biotechnologicznej. (2019). Brom. Baza danych PubChem. CID = 23968. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Ross Rachel. (8 lutego 2017). Fakty dotyczące bromu. Odzyskany z: livesscience.com
- Wikipedia. (2019). Boraks. Odzyskane z: en.wikipedia.org
- Lenntech B. V (2019). Brom. Odzyskany z: lenntech.com


Jeszcze bez komentarzy